임상, 공중 보건, 글로벌 보건 지식을 제공하는 세계 최고의 논문지 (Impact Factor 168·9 (2022) 로 알려진 Lancet에 게제된 인체 주요 장기 중 나노 및 미세플라스틱 관련 논문입니다.
제목: The potential impacts of micro-and-nano plastics on various
organ systems in humans
인간의 다양한 장기(조직)에 대한 미세플라스틱 및 나노플라스틱의 잠재적 영향
About Lancet
임상, 공중 보건, 글로벌 보건 지식을 제공하는 세계 최고의 소스입니다.
이 저널의 Impact Factor 168·9 (2022 Journal Citation Reports®, Clarivate 2023)로 전 세계 167개 일반 및 내과 저널 중 1위를 차지했으며, Scopus CiteScore는 133·2로 830개 일반 의학 저널 중 2위를 기록했습니다.
Summary 요약
인간은 다양한 경로를 통해 미세 및 나노 플라스틱(MNP)에 노출되지만, MNP가 다양한 장기(조직) 시스템에 미치는 건강상의 악영향은 아직 완전히 이해되지 않았습니다.
이 검토는 다양한 기관 시스템에 대한 MNP의 잠재적 영향에 대한 개요를 제공하고 현재 연구에서 지식 격차를 식별하는 것을 목표로 합니다. 요약된 결과는 MNP에 노출되면 산화 스트레스, 염증, 면역 기능 장애, 생화학적 및 에너지 대사 변경, 세포 증식 손상, 미생물 대사 경로 중단, 비정상적인 장기 발달 및 발암성을 통해 건강에 영향을 미칠 수 있음을 시사합니다.
동물 및 세포 연구의 증거에도 불구하고 MNP가 건강에 미치는 영향에 대한 인간 데이터는 제한적입니다.
발표된 연구의 대부분은 독성을 평가하기 위해 특정 유형의 MNP에 초점을 맞춘 반면, 환경에서 흔히 발견되는 다른 유형의 플라스틱 입자는 아직 연구되지 않은 상태입니다.
향후 연구에서는 현실적인 농도, 용량 의존적 효과, 개별 민감성 및 교란 요인을 고려하여 MNP 노출을 조사해야 합니다.
Humans are exposed to micro-and-nano plastics (MNPs) through various routes, but the adverse health effects of MNPs on different organ systems are not yet fully understood. This review aims to provide an overview of the potential impacts of MNPs on various organ systems and identify knowledge gaps in current research. The summarized results suggest that exposure to MNPs can lead to health effects through oxidative stress, inflammation, immune dysfunction, altered biochemical and energy metabolism, impaired cell proliferation, disrupted microbial metabolic pathways, abnormal organ development, and carcinogenicity. There is limited human data on the health effects of MNPs, despite evidence from animal and cellular studies. Most of the published research has focused on specific types of MNPs to assess their toxicity, while other types of plastic particles commonly found in the environment remain unstudied. Future studies should investigate MNPs exposure by considering realistic concentrations, dose-dependent effects, individual susceptibility, and confounding factors.
http://creativecommons.org/licenses/by/4.0/
www.thelancet.com Vol 99 January, 2024
Keywords
#Microplastic #Nanoplastics #Human exposure #Organ system #Health effects #Toxicity
Search strategy and selection criteria
검색 전략 및 선택 기준
이 검토에 대한 관련성 있고 최근 연구를 식별하기 위해 다음 키워드를 사용하여 Science Direct, PubMed/Medline 및 Google Scholar와 같은 과학 데이터베이스를 검색했습니다: 미세 및 나노 플라스틱 AND [건강 OR 부작용 OR 독성, OR 호흡계 OR 심혈관계 또는 간계 또는 신장계, 위장계 또는 생식계, 내분비계 또는 근골격계, 또는 신경계 또는 면역계 또는 대사 효과 또는 기타 효과]. 영어로 출판된 기사만 포함되었습니다.
To identify relevant and recent studies for this review, scientific databases such as Science Direct, PubMed/Medline and Google Scholar were searched, using the following keywords: micro-and-nano plastics AND [health OR adverse effects OR toxicity, OR respiratory system OR cardiovascular system or hepatic system OR renal system, gastrointestinal system OR reproductive system, OR endocrine system OR musculoskeletal system, OR nervous system OR immune system OR metabolic effects OR other effects]. Only articles published in English were included.
Introduction
도입
플라스틱의 산업적 이점은 널리 퍼져 있습니다. 생산량은 2050년까지 4배로 증가할 것으로 예상됩니다.1
그러나 다양한 환경 틈새(공기, 물 또는 땅)에 광범위하게 분포하고 존재하기 때문에 인간은 여러 경로를 통해 노출에 취약하게 됩니다(Domenech and Marcos, 2021).
플라스틱 재료는 산화, 가수분해, 광분해, 기계적 분해 및 생분해를 통해 분해되어 다양한 형태와 크기의 잔해를 생성하며 "미세플라스틱"이라는 용어로 이어지며, 보다 최근에는 플라스틱 나노입자(100 nm 이하), 나노플라스틱(100 nm) –1000 nm), 미세플라스틱(1 μm < 1000 μm), 중형 플라스틱(0.5~5 cm), 매크로 플라스틱(5~50 cm), 거대 플라스틱(>50 cm).3,4
미세플라스틱(MP)은 청소 제품 및 비료를 포함한 상업용 제품(1차 MP)에 첨가되거나 더 큰 플라스틱 재료(2차 MP)의 분해를 통해 생성됩니다.5
MP의 하위 집합인 나노플라스틱(NP)은 일반적으로 다음 중 하나에서 생성됩니다. MP의 단편화에 의해 또는 전자제품, 페인트, 접착제 등에 사용되는 플라스틱 재료와 같은 다른 소스에서 방출됩니다.6,7
2차 MP 및 NP는 일반적으로 전단력을 통한 매크로 플라스틱의 분해에 의해 생성되며,8 약 70~80%를 차지합니다.
자연 환경으로 배출되는 총 플라스틱 중 일차 MP는 15~30%를 차지합니다.9
MP는 직물(기저귀, 양털, 일회용 마스크)의 미세섬유, 산업계의 파편, 플라스틱 펠릿, 덩어리 거품 및 마이크로비드.10,11 등 다양한 형태로 존재합니다.
인간은 아래 설명된 바와 같이 섭취, 흡입 및 피부 접촉을 통해 MNP에 노출됩니다.12,13
The industrial benefits of plastics are widespread; production is expected to quadruple by 2050.1 However, their widespread distribution and presence in various environmental niches (air, water, or land) make humans vulnerable to exposure through multiple routes (Domenech and Marcos, 2021). Plastic materials are broken down through oxidation, hydrolytic degradation, photodegradation, mechanical degradation and biodegradation, producing various forms and sizes of debris, leading to the term “microplastic”2 and, more recently: plastic nanoparticles (≤100 nm), nanoplastic (100–1000 nm), microplastics (1 μm < 1000 μm), mesoplastics (0.5–5 cm), macroplastics (5–50 cm), and megaplastics (>50 cm).3,4
Microplastics (MPs) are added to commercial products (primary MPs), including cleaning products and fertilisers, or are produced through the degradation of larger plastic materials (secondary MPs).5 Nanoplastics (NPs), a subset of MPs, are typically generated either by the fragmentation of MPs or released from other sources such as plastic materials used in electronics, paints, adhesives etc.6,7 Secondary MPs and NPs are generally produced by the breakdown of macroplastics via shear forces,8 accounting for about 70–80% of total plastic released into the natural environment, while primary MPs account for 15–30%.9 MPs are present in different forms, such as microfibers from textiles (diapers, fleeces, and disposable masks), fragments, plastic pellets and nurdles from industry, foam, and microbeads.10,11 Humans are exposed to MNPs through ingestion, inhalation and skin contact,12,13 as described below.
CC BY 4.0 Deed | Attribution 4.0 International | Creative Commons
You are free to: Share — copy and redistribute the material in any medium or format for any purpose, even commercially. Adapt — remix, transform, and build upon the material for any purpose, even commercially. The licensor cannot revoke these freedoms
creativecommons.org

Dietary exposure
식이 노출
인간 대변에 MP가 있다는 증거는 식이 요법을 통해 섭취된다는 것을 확인시켜 줍니다.14
MNP는 주로 식품, 식수 및 플라스틱 식품 포장에서 발견되며15 연령, 성별, 식이 요법 및 생활 방식에 따라 노출 수준이 다양합니다.
야생동물 종은 또한 MNP를 섭취하여 먹이 사슬과 우리 식단에 들어가며16,17 식품 안전에 심각한 위협을 가합니다.
수생 환경에 MP가 존재하기 때문에 다양한 종류의 해산물에서 검출되었습니다.18, 19, 20, 21
이매패류의 전체 연조직 섭취는 낮은 수준이지만 MP에 대한 인체 노출의 원인입니다.22,23 독일(0.36 입자/g), 프랑스, 벨기에 및 네덜란드(0.2 입자/g)의 양식 이매패류에서 발견됩니다.22,24
캐나다에서는 동일한 유형의 이매패류에서 500배 더 높은 수준의 MP가 관찰되었으며, 이는 MPs 수준은 지역과 추출 방법에 따라 다를 수 있습니다.25 영국의 한 연구에서는 소비자가 가공된 홍합 100g에 70개의 미세 플라스틱 품목을 섭취할 것으로 예측했습니다.26
식탁용 소금(1~10 MPs/kg)은 MPs 노출의 또 다른 원인입니다.27
MPs 입자는 동물성 플랑크톤 유기체에서도 검출되었으며,28,29
MP가 먹이 사슬에 들어갈 수 있음을 시사합니다.
생수 및 우유와 같은 가공 식품은 가공 및 포장 과정에서 유입되는 MP에 취약하지만 그 위험성은 불분명합니다.30
또한 우리 식단에 포함된 MNP는 공기, 주로 실내에서 축적될 수 있습니다.31
식품과 환경은 폴리에틸렌테레프탈레이트(PET), 폴리에틸렌(PE), 폴리프로필렌(PP), 폴리염화비닐(PVC), 폴리스티렌(PS), 폴리에스테르(PES), 폴리우레탄(PU), 폴리아미드(PA), 스티렌 아크릴레이트 및 폴리메틸메타크릴레이트(PMMA).16,32
Evidence of MPs in human stool confirms their ingestion through diet.14 MNPs are primarily found in food, drinking water and plastic food packaging,15 with varied exposure levels depending on age, sex, diet and lifestyle. Wildlife species also ingest MNPs, entering the food chain and our diets,16,17 posing a significant threat to food safety. Due to the presence of MPs in aquatic environments, it has been detected in different types of seafood.18, 19, 20, 21 Consumption of the whole soft tissue of bivalves is a source of human exposure to MPs,22,23 although low levels are found in farmed bivalves from Germany (0.36 particles/g), France, Belgium and the Netherlands (0.2 particles/g).22,24 In Canada, 500-fold higher levels of MPs were observed in the same type of bivalves, indicating that the levels of MPs may vary by geography as well as extraction methods.25 A UK study predicted consumers' ingestion of 70 microplastic items in 100 g processed mussels.26
Table salt (1–10 MPs/kg) is another source of MPs exposure.27 MPs particles have also been detected in zooplanktonic organisms,28,29 suggesting MP could enter the food chain. Processed foods such as bottled water and milk are vulnerable to MPs introduced during processing and packaging, but their risk is unclear.30 In addition, MNPs in our diet can be deposited from the air, mainly indoors.31 MP particles that were commonly detected in foodstuffs and the environment are comprised of polyethene-terephthalate (PET), polyethene (PE), polypropylene (PP), polyvinyl chloride (PVC), polystyrene (PS), polyester (PES), polyurethane (PU), polyamide (PA), styrene acrylate and polymethyl-methacrylate (PMMA).16,32
Exposure through inhalation
흡입을 통한 노출
흡입은 인간이 MNP에 노출되는 또 다른 중요한 경로입니다.
공기 중 MP의 가정된 원인은 합성 섬유, 건축 자재, 도로 마모 입자, 플라스틱 재료의 마모, 매립지, 하수 슬러지 및 폐기물 소각입니다. 12,33, 34, 35
MP는 실내 공기에서 발견되었으며 실내 공기 중 미립자의 4%를 구성했습니다.36
MP는 인간의 호흡계에 도달하여 건강에 해로운 영향을 미칠 수 있습니다.
산업 근로자는 MPs에 노출되기 더 쉽습니다.37,38
공기역학적 크기는 흡입된 기도 내 입자 분포의 깊이를 결정하는 결정적인 요소입니다.
입자가 작을수록 더 깊은 폐 부위에 도달할 가능성이 높아집니다. 공기역학적 크기가 2.5미크론 미만인 흡입 미립자 물질은 가스 교환과 상피 세포에서 내피 세포로의 입자 이동이 일어나는 폐포에 도달할 가능성이 높기 때문에 우려됩니다.39
Inhalation is another significant route of human exposure to MNPs. The hypothesised sources of airborne MPs are synthetic textiles, construction materials, road-wear particles, abrasions of plastic materials, landfills, sewage sludge, and waste incineration.12,33, 34, 35 MPs were found in indoor air, constituting 4% of indoor airborne particulates.36 It has been estimated that, on average, an individual inhales up to 130 MPs per day.12 MPs can reach the human respiratory system and cause adverse health effects; industrial workers are more susceptible to exposure to MPs.37,38 Aerodynamic size is a defining factor in determining the depth of particle distribution within the airways once inhaled. The smaller the particle, the more likely it is to reach deeper lung regions. Inhaled particulate matter below 2.5 microns in aerodynamic size is of concern due to the higher probability of reaching the alveolar sacs, where gas exchange and particle translocation from epithelial to endothelial cells occurs.39
Exposure through dermal contact
피부 접촉을 통한 노출
피부 노출은 가장 덜 중요한 진입 경로로 간주되지만, NP가 피부 장벽을 통과할 수 있다는 증거가 있습니다.13
개인 위생용품에 포함된 합성 섬유 및 마이크로비드의 대기 낙진은 MNP에 대한 피부 노출의 주요 원인입니다.40
그러나 이 문제는 점점 더 많은 국가에서 개인 위생용품과 세제에 마이크로비드 사용을 금지하고 있기 때문에 이에 대한 우려는 점점 줄어들고 있습니다.
일단 섭취되거나 흡입되면 생물학적으로 이용 가능한 크기의 MNP 입자는 물리화학적 특성에 따라 내부 장기로 이동할 수 있으며 유효 내부 용량을 초과하는 경우 세포 수준에서 유해한 영향을 일으킬 수 있습니다.41
그러나 이에 대한 명확한 이해는 여전히 부족합니다.
이 입자의 유효 내부 용량. 유효 내부 선량을 이해하는 것은 노출 위험 평가에 매우 중요합니다.
이는 측정된 물리적 양과 생물학적 효과 사이의 알려진 관계를 나타내기 때문입니다.
MP에 대한 인체 노출을 판단할 때 물, 식품 또는 공기에 존재하는 폴리머 유형, 질량, 크기 및 수에 대한 데이터가 필요합니다.42
그러나 인체 노출에 대한 연구는 아직 충분한 데이터를 제공하지 못했습니다.
반면, MP의 독성학적 종말점과 환경적으로 관련된 인간 노출량과의 관계에 대해서는 알려진 바가 거의 없습니다.43
또한 대부분의 연구는 주로 깨끗한 입자에 초점을 맞추었는데,44 이는 2차 MP의 복잡성을 반영하지 않습니다.
다양한 모양, 코로나 형성, 첨가제 등으로 형성된 것들입니다.
이 검토의 목적은
(i) 인체의 다양한 기관 시스템에 대한 MNP의 잠재적 영향을 논의하고,
(ii) 기존 지식의 격차를 확인하고,
(iii) 향후 연구에 대한 권장 사항을 제공하는 것입니다.
While dermal exposure is considered the least important entry route, evidence suggests that NPs can pass through the skin barrier.13 Atmospheric fallout of synthetic fibres and microbeads in personal care products are the major sources of dermal exposure to MNPs.40 However, this issue is becoming less of a concern as more and more countries are banning microbeads in personal care products and detergents.
Once ingested or inhaled, MNP particles of a bioavailable size could translocate to internal organs, dependent on their physicochemical properties, and cause harmful effects at the cellular level if above an effective internal dose.41 However, there is still a lack of clear understanding regarding the effective internal dose of these particles. Understanding the effective internal dose is crucial for exposure risk assessment, as it indicates a known relationship between measured physical quantities and biological effects. When determining human exposure to MPs, it is necessary to have data on the polymer types, masses, sizes, and numbers present in water, food, or air.42 However, studies on human exposure have not yet provided sufficient data. On the other hand, little is known about the toxicological endpoints of MPs and their relation to environmentally relevant human exposure doses.43 Additionally, most of the studies have primarily focused on pristine particles,44 which do not reflect the complexity of secondary MPs, such as those formed from different shapes, corona formation, additives, and more. This review aims to (i) discuss the potential effects of MNPs on various organ systems in the human body, (ii) identify the gaps in the existing knowledge, and (iii) provide recommendations for future research.
Cellular uptake of MNPs
MNP의 세포 흡수
신체에 흡수된 후 일부 MP 및 NP는 입자 크기, 입자의 표면 특성, 탄수화물, 단백질 및 인지질을 포함하여 이들이 접하는 생물학적 분자와 같은 여러 요인에 따라 세포와 상호 작용할 수 있습니다.45
나노 입자가 생물학적 분자와 상호 작용하면 체액이 조직이나 기관과 접촉하게 되면 단백질 분자에 노출되어 단백질 코로나라고 불리는 '왕관'을 형성합니다.46
시험관 내 연구에서는 단백질 코로나로 코팅된 폴리스티렌 나노입자가 단백질의 양과 구성에 영향을 받아 더 높은 전위 속도를 촉진한다는 사실이 입증되었습니다.47
또한, 단백질 코로나는 세포 환경에 따라 나노입자의 형태와 특성을 변경하여 잠재적으로 세포 상호 작용과 독성을 증가시킬 수 있습니다.48 따라서 MNP에도 동일한 일이 일어날 가능성이 있습니다.
MP와 NP의 세포 흡수는 여러 가지 방법으로 발생할 수 있습니다. 이 중에서 세포내이입은 나노입자의 접착 상호작용이나 세포막 비활성 투과가 채널 또는 수송체 단백질과 함께 발생하는 중요한 경로입니다.
세포내이입 경로에는 식세포작용과 미세음세포작용, 클라트린 및 카베올라에 매개 세포내이입이 포함됩니다.49, 50, 51
이전에는 크기가 200 nm 미만인 라텍스 비드는 세포내이입을 통해 포유류 HeLa 세포와 Caenorhabditis elegans coelomocyte에 흡수되었습니다.52
세포 유형은 세포 흡수 방식뿐만 아니라 입자의 물리화학적 특성에도 영향을 미칩니다.
아미딘 그룹으로 표면 변형된 폴리스티렌 나노입자(120 nm)는 비세포내이입 경로를 통해 쥐의 폐포 상피 세포에 침투할 수 있습니다.53,54
최근 연구에서 22명의 건강한 지원자의 소화된 혈액에서 플라스틱 중합체 특징(≥700 nm)이 검출되었습니다. 55
그러나 이들 중합체의 입자 크기 분포는 알려져 있지 않습니다. 게다가 대부분의 연구에서는 폴리스티렌 입자를 사용했습니다. 따라서 다른 유형의 MP 입자의 세포 흡수 과정을 살펴보는 것이 중요합니다.
After absorption into the body, some MPs and NPs may interact with cells, dependent on several factors, such as particle size and surface properties of the particles and the biological molecules they encounter, including carbohydrates, proteins and phospholipids.45 Once nanoparticles interact with biological fluids and come into contact with tissues or organs, they are exposed to protein molecules, which form a ‘crown’ called a protein corona.46 In vitro studies have demonstrated that polystyrene nanoparticles coated with a protein corona facilitate higher translocation rates, influenced by the amount and composition of proteins.47 Moreover, protein coronas may alter the form and characteristics of nanoparticles according to the cellular environment, potentially increasing cell interactions and toxicity.48 Thus, there is potential for the same to happen to MNPs.
Cellular uptake of MPs and NPs can occur in several ways. Among these, endocytosis is a crucial pathway where adhesive interactions of nanoparticles or cell membrane inactive permeation occur with channel- or transporter proteins. Endocytic pathways include phagocytosis and micropinocytosis, as well as clathrin- and caveolae-mediated endocytosis.49, 50, 51 Previously, latex beads <200 nm in size were taken up by mammalian HeLa cells and Caenorhabditis elegans coelomocytes via endocytosis.52
Cell types influence the mode of cellular uptake, as well as the particle physicochemical properties. Polystyrene nanoparticles (120 nm) surface-modified with amidine groups can permeate rat alveolar epithelial cells via non-endocytic pathways.53,54 In a recent study, plastic polymer signatures (≥700 nm) were detected in the digested blood of 22 healthy volunteers.55 However, the particle size distribution of these polymers is unknown. Moreover, most studies used polystyrene particles; therefore, looking at the cellular uptake process of other types of MPs particles is important.
Translocation and biodistribution of MNPs
MNP의 전좌 및 생체분포
MNP의 전위 및 분포를 이해하는 것은 유기체에 대한 독성 및 건강 위험을 평가하는 데 유용할 수 있습니다.
유기체에서의 MNP 섭취, 생체 축적 및 독성에 대한 여러 리뷰가 있습니다56,57;
그러나 유기체 내에서의 전달에 대한 검토는 제한적입니다. 수많은 연구에서 수천 종의 유기체, 특히 수생 동물에서 MP의 이동과 분포가 나타났으며, 어류가 가장 널리 연구된 종이었습니다.
MNP는 소화관을 통해 체내로 들어가거나 아가미나 폐를 통한 흡입을 통해 체내로 들어갑니다.
MNP는 어류의 소화관61, 인간의 폐62, 혈액63, 심장63 및 간경변 간 조직64뿐만 아니라 수생 생물의 근육, 간, 생식선, 포유류의 신장, 비장, 태반에서도 발견되었습니다. 65, 66, 67
이러한 조직에 축적되면 동물을 위협하고 인간의 건강 위험을 증가시킵니다.68
MNP가 섭취되면 대부분이 소화관을 통과하여 배설됩니다.69,70
그러나 작은 부분은 며칠 동안 장에 남아 있습니다.69
장의 MNP는 세포내이입 과정을 통해 세포 내로 흡수될 수 있습니다. 60
장에서 MNP는 손상과 염증을 일으켜 혈류로 들어가 다른 조직으로 전파되고 장기간 지속될 수 있습니다.71
Wick et al. (2010)은 생체외 인간 태반 관류 모델을 사용하여 최대 240 nm 직경의 PS-NP가 태반 장벽을 투과하여 태반을 통과할 수 있음을 입증했습니다.72
경구 흡수 후 나노입자 생체 이용률은 장 전위에 따라 달라집니다. 시험관 내 연구에서 세 가지 장 세포 모델이 나노입자 전위에 대해 평가되었습니다.47
결과는 NP 크기와 표면 화학이 전위에 영향을 미치는 것으로 나타났으며, 50 nm 나노입자는 100 nm NP(0.8%)보다 더 높은 전위율(최대 7.8%)을 나타냈습니다. ).
전반적으로 MNP의 이동은 플라스틱 입자 특성, 동물의 행동 및 발달을 포함한 다양한 요인의 영향을 받습니다.73
독성, 분포, 체내 축적을 포함하여 MP의 건강 위험을 이해하려면 추가 연구가 필요합니다.
Understanding the translocation and distribution of MNPs can be useful in assessing toxicity and health risks to organisms. There are several reviews on the ingestion, bioaccumulation, and toxicity of MNPs in organisms56,57; however, reviews on their transfer within organisms are limited. Numerous studies have shown the translocation and distribution of MPs in thousands of organisms, particularly aquatic animals,58, 59, 60 with fishes being the most widely studied species.
MNPs enter the body through the digestive tract or inhalation via gills or lungs. MNPs have been found in the digestive tracts of fish,61 in human lungs,62 blood,63 heart63 and cirrhotic liver tissue64 as well as in the muscle, liver, and gonads of aquatic organisms and the kidney, spleen, and placenta of mammals.65, 66, 67 Their accumulation in these tissues threatens animals and increases human health risks.68
When MNPs are ingested, a major portion of them are passed through their digestive tracts and get excreted.69,70 However, a small portion remains in the intestines for several days.69 MNPs in the gut can be internalized in cells through endocytotic processes.60 In the intestine, MNPs can cause damage and inflammation, entering the bloodstream, disseminating to other tissues, and persisting for prolonged periods.71 A study by Wick et al. (2010) using an ex vivo human placental perfusion model demonstrated that PS-NPs with diameters up to 240 nm can permeate the placental barrier and undergo transplacental transfer.72 Nanoparticle bioavailability after oral uptake depends on intestinal translocation. In an in vitro study, three intestinal cell models were evaluated for nanoparticle translocation.47 Results showed that NP size and surface chemistry affected translocation, with 50 nm nanoparticles having a higher translocation rate (up to 7.8%) than 100 nm NPs (0.8%). Overall, the transfer of MNPs is influenced by various factors, including plastic particle characteristics and animal behaviour and development.73 Further research is necessary to understand the health risks of MPs, including their toxicity, distribution, and accumulation in the body.
Impact of MNPs on organ systems
MNP가 장기 시스템에 미치는 영향
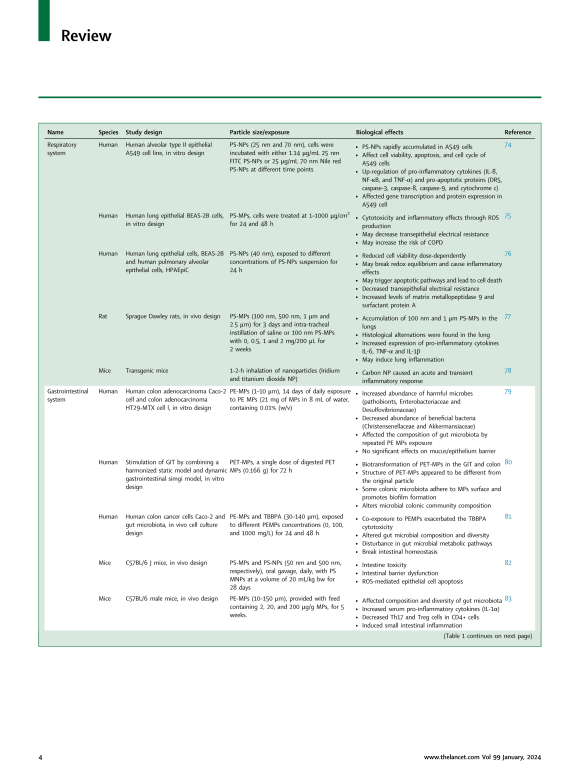
노출 후 순환계로 유입된 생체 이용 가능 입자는 2차 기관으로 이동하여 세포 수준에서 부작용을 초래할 수 있는 수준으로 축적될 수 있습니다. 여러 생체 내 및 시험관 내 연구에서 MNP가 해로운 결과를 초래할 수 있음이 밝혀졌습니다. 다양한 장기 시스템에 대한 MNP의 영향은 아래에 설명되어 있으며 요약은 표 1과 그림 1에 나와 있습니다.
Following exposure, bioavailable particles that enter the circulatory system can translocate to secondary organs, where they might accumulate to a level that could result in adverse effects at the cellular level. Several in vivo and in vitro studies have revealed that MNPs can have detrimental consequences. The impacts of MNPs on different organ systems have been described below, and the summary is presented in Table 1 and Fig. 1.
Table 1Overview of potential effects of MNPs in various organ systems in humans and animals.
표 1. 인간과 동물의 다양한 기관계에 MNP가 미치는 잠재적 영향에 대한 개요





Respiratory system
호흡기 체계
흡입은 인간이 MNP에 노출되는 주요 경로 중 하나입니다.
그러나 공기 중 MNP가 호흡기계에 어느 정도 악영향을 미치는지는 아직 명확하지 않습니다.
흡입된 MNP의 대부분은 기계적 과정, 식균작용 또는 림프 수송을 통해 제거될 수 있습니다.108
그러나 일부 얇은 섬유는 여전히 폐포, 폐포관 및 말단 세기관지에 침착되어 만성 염증 및 섬유증을 유발할 수 있습니다.109,110
조직 손상의 정도는 일반적으로 장기간에 걸친 흡입량에 따라 달라집니다.111
최근 연구에 따르면 인간의 폐 조직62 및 가래 샘플112에서 MP가 확인되었으며,112 이는 흡입이 플라스틱 입자가 인체에 유입되는 중요한 경로임을 나타냅니다.
세포 배양에 대한 여러 연구에서는 호흡기 독성 모델 역할을 하는 인간 폐 상피 세포에 대한 MNP 입자의 잠재적 영향을 평가했습니다.
Xu 등의 한 연구. (2019)는 직경 25 nm 및 70 nm의 PS-NP 입자가 인간 폐포 상피 세포주 A549에 미치는 영향을 조사했습니다.74
결과는 PS-NP가 세포 손상, 염증 및 세포 사멸을 유발하는 것으로 나타났습니다.
그들은 또한 전염증성 사이토카인과 세포사멸 촉진 단백질의 상향 조절을 촉발했는데, 이는 PS-NP가 TNF-α 매개 세포사멸 경로에 영향을 미쳤음을 나타냅니다.74
TNF-α 발현 증가는 천식에서 기도 염증과 관련이 있습니다. 또 다른 연구에서 PS-MP는 ROS 생성을 증가시켜 인간 폐 세포(BEAS-2B)의 염증과 세포 독성을 증가시키는 것으로 밝혀졌습니다.75
고용량의 PS-MP에 노출되면 만성 폐쇄성 폐질환(COPD)의 위험이 증가할 수 있습니다.
특히 α1-항트립신 수치가 낮은 개인에게서 나타났습니다.75
또 다른 연구에서는 인간 폐 세포(BEAS-2B 및 HPAEpiC)를 PS-NP에 노출시키면 용량 의존적으로 세포 생존력이 감소했습니다.76
PS-NP도 산화 환원 불균형, 염증, 세포 사멸 경로 및 세포 사멸을 유발하는 것으로 밝혀졌습니다.
또한, 이 연구는 산화환원 불균형이 PS-NPs로 인한 폐 손상에 중요한 역할을 할 수 있음을 시사했습니다.
PS-NP 처리된 세포에서 매트릭스 메탈로펩티다제 9 및 계면활성제 단백질 A의 수준 증가가 관찰되었는데, 이는 폐의 회복 능력 및 잠재적인 조직 손상의 감소를 나타냅니다.76
동물 연구에서, 쥐의 낭포성 섬유증 모델에서 폐는 흡입된 나노입자(이리듐 및 이산화티타늄 나노입자)에 대한 감수성이 증가한 것으로 나타났습니다.78 또 다른 연구에서는 PS-MP(100 nm, 500 nm, 1 μm 및 2.5 μm)를 경기관 주사하여 3일) 쥐의 폐포 세척액에서 전염증성 사이토카인(TNF-α, IL-6 및 IL-1β)의 발현을 유발했습니다.77
MNP는 호흡 상피에 도달하여 확산, 세포 침투 또는 세포 흡수와 같은 여러 과정을 통해 이동합니다.113
폐포에서 가장 작은 입자(<1 μm)는 일반적으로 막 구멍을 통한 확산 과정을 따르는 반면, 크기 1 입자의 경우 –3 μm, 식균작용이 주요 수송 경로입니다.114
흡입된 나노입자의 독성학적 효과는 폐 계면활성제(PS) 필름과의 상호작용에 따라 달라집니다.
시험관 내 및 실리코 연구에 따르면 친수성 나노입자는 PS 필름을 빠르게 가로질러 이동하는 반면 소수성 나노입자는 달라붙어 지질 돌출부 내에 갇혀 있는 것으로 나타났습니다.115
이 연구는 서로 다른 물리화학적 특성을 지닌 흡입된 나노입자에 연결된 새로운 PS 지단백질 코로나 모델을 제안합니다.115
나노입자는 또한 다양한 표면 장력과 지질 패킹으로 인해 다양한 호흡 단계에서 계면활성제를 교차시킵니다.116
분자 수준에서의 연구에 따르면 적절한 지질 패킹과 소수성 단백질 조립이 건강한 폐 계면활성제 필름에 중요하다는 것이 밝혀졌습니다.117,118
다른 연구에서는 PS의 상호 작용을 보고했습니다.
- 독성 정도에 영향을 미치는 것으로 보이는 단백질과 같은 생물학적 구성 요소를 포함하는 NP.119 또한 폐에서 PS는 ZnO 나노와이어(ZnONW)의 특성을 변경하여 상피 세포의 내재화 및 처리에 영향을 미칠 수 있습니다.120
전반적으로 이는 흡입된 MP와 NP가 표면에 결합하는 분자에 따라 흡수 수준이 다를 수 있음을 시사합니다.
위의 연구 결과는 MNP 흡입이 산화 스트레스 및 염증 반응을 통해 호흡기 건강에 영향을 미칠 수 있으며, 이어서 상피 장벽 파괴 및 세포 사멸로 이어져 장기간 노출 후 조직 손상 및 호흡기 질환을 유발할 수 있음을 나타냅니다.
Inhalation is one of the main routes of human exposure to MNPs. However, it is not clear yet to what extent airborne MNPs cause adverse effects on the respiratory system. A major part of the inhaled MNPs can be cleared through a mechanical process, phagocytosis or lymphatic transport.108 However, some thin fibres can still be deposited in alveoli, alveolar ducts, and terminal bronchioles, leading to chronic inflammation and fibrosis.109,110 The severity of tissue damage typically depends on the inhaled dose over a prolonged period.111 Recent studies have identified MPs in human pulmonary tissue62 and sputum samples,112 indicating that inhalation is an important route for plastic particles to enter the human body.
Several studies on cell cultures have assessed the potential effects of MNP particles on human lung epithelial cells, which serve as a model for respiratory toxicity. One study by Xu et al. (2019) examined the impacts of PS-NPs particles, with 25 nm and 70 nm diameters, on the human alveolar epithelial cell line A549.74 The results showed that PS-NPs caused cell damage, inflammation, and apoptosis. They also triggered the up-regulation of pro-inflammatory cytokines and pro-apoptotic proteins, indicating that PS-NPs influenced the TNF-α-mediated apoptosis pathway.74 Increased TNF-α expression is associated with airway inflammation in asthma. In another study, PS-MPs have been found to increase inflammation and cytotoxicity in human lung cells (BEAS-2B) by increasing ROS production.75 Exposure to high doses of PS-MPs may increase the risk of chronic obstructive pulmonary disease (COPD), especially in individuals with lower levels of α1-antitrypsin.75 In another study, exposure of human lung cells (BEAS-2B and HPAEpiC) to PS-NPs caused reduced cell viability in a dose-dependent manner.76 PS-NPs were also found to cause redox imbalance, inflammation, apoptotic pathways, and cell death. Furthermore, the study suggested that redox imbalance could play a key role in PS-NPs-induced lung injury. Increased levels of matrix metallopeptidase 9 and Surfactant protein A were observed in PS-NPs treated cells, indicating a decrease in the lung's repair ability and potential tissue damage.76
In animal studies, lungs showed an increased susceptibility to inhaled nanoparticles (Iridium and titanium dioxide nanoparticles) in a murine cystic fibrosis model.78 In another study, transtracheal injection of PS-MPs (100 nm, 500 nm, 1 μm and 2.5 μm for 3 days) caused the expression of pro-inflammatory cytokines (TNF-α, IL-6, and IL-1β) in alveolar lavage fluid in rats.77
MNPs reach the respiratory epithelium and translocate via several processes, such as diffusion, cellular penetration, or cellular uptake.113 In the alveoli, the smallest particles (<1 μm) generally follow a diffusion process across membrane pores, whereas, for particles sized 1–3 μm, phagocytosis is the main pathway of transportation.114 The toxicological effect of inhaled nanoparticles depends on their interaction with the pulmonary surfactant (PS) film. In vitro and silico studies indicated that hydrophilic nanoparticles quickly move across the PS film, while hydrophobic nanoparticles get stuck and are enclosed within lipid protrusions.115 The study suggests a new PS lipoprotein corona model linked to inhaled nanoparticles with different physicochemical properties.115 Nanoparticles may also cross the surfactant at different breathing stages due to varying surface tension and lipid packing.116 Studies at the molecular level have shown that proper lipid packing and hydrophobic protein assembly are crucial for a healthy lung surfactant film.117,118 Other studies reported an interaction of PS-NPs with biological components such as proteins, termed “corona”, which appears to affect the degree of toxicity.119 Moreover, in the lung, PS can alter ZnO nanowire's (ZnONWs) properties, affecting their internalization and processing by epithelial cells.120 Overall, this suggests that inhaled MPs and NPs might differ in their level of uptake based on the molecules that bind to their surface. The above study findings indicate that MNPs inhalation may affect respiratory health through oxidative stress and inflammatory reactions, followed by epithelial barrier destruction and cellular death, resulting in tissue damage and respiratory disease after long-term exposure.
Gastrointestinal system
위장관계
손상된 위장관(GIT) 기능은 에너지 항상성 조절을 방해합니다.
MP와 NP가 GIT에 쉽게 축적될 수 있다는 증거가 있습니다.121,122
그러나 MNP가 인간 장내 미생물군, 염증 및 관련 메커니즘에 미치는 영향은 아직 완전히 이해되지 않았습니다.
Fournier 등의 연구. (2023)은 Caco-2와 점액 분비세포.79 의 공동 배양과 결합된 M-ARCOL(Mucosal Artificial Colon) 모델을 사용하여 인간 장내 미생물 장 장벽에 대한 폴리에틸렌(PE) MP(1–10 μm)의 효과를 평가했습니다.
PE-MP(14일 동안 8mL의 물에 MP 21mg)에 노출되면 병원균, Desulfovibrionaceae 및 Enterobacteriaceae와 같은 유해 미생물이 증가한 반면 구성 및 대사 활동 측면 Christensenellaceae 및 Akkermansiaceae와 같은 유익한 미생물은 감소했습니다.
그러나 점액/상피 장벽의 투과성과 염증에는 유의미한 영향이 없었습니다.79
이 연구는 인간 장에 대한 MPs 노출 효과에 대한 중요한 정보를 제공하지만, 가장 큰 제한점은 완전히 대표되지 않는 처녀 PE 마이크로비드만 사용했다는 것입니다.
구형 형태에 따른 섭취 형태의 비율.79 더욱이, 관찰된 효과가 고용량의 PE-MP로 인한 것인지 또는 지속성 입자로 인한 것인지는 불분명합니다.
이는 다른 MP 유형이나 다른 입자를 포함하여 명확해질 수 있습니다. 연구에 따르면 폴리에틸렌 테레프탈레이트(PET)-MP는 인간의 소화관과 결장에서 생체 변형을 겪어 결장의 입자 구조와 미생물 군집 구성을 변화시킬 수 있습니다.80
별도의 연구에 따르면 PE-MP의 동시 노출은 테트라브로모비스페놀 A(TBBPA) 세포 독성을 유발하고 장내 미생물 구성, 다양성 및 대사 경로를 변경하여 영양 대사를 방해하여 궁극적으로 장내 항상성을 깨뜨릴 수 있습니다.81
플라스틱 분해 효소를 암호화하는 유전자가 인간 장내 미생물군집에서 발견되었습니다. 장내 미생물군집을 MP 오염으로 전환합니다(Nugrahapraja et al., 2022).
동물 연구에서 MP 노출은 장 시스템에 부작용을 일으키는 것으로 나타났습니다. PS-NP와 PS-MP(각각 50 nm 및 500 nm, 20 mL/kg bw의 농도로 28일 동안)에 노출되면 생쥐 모델에서 ROS 생성을 통해 상피 세포 사멸에 의한 장 장벽 기능 장애가 발생했습니다.82
생쥐 모델을 대상으로 한 연구에서 다양한 농도(5주 동안 2, 20, 200 μg/g)의 PE-MP(10~150 μm)에 노출되면 더 많은 장내 미생물 종, 박테리아 풍부도 증가, 식물군 다양성 및 전염증성 증가가 나타났습니다. 사이토카인 분비.83
연구 결과는 PE-MP에 노출되면 TLR4 신호 전달 경로를 통해 장내 세균 이상증과 염증을 유발할 수 있음을 시사합니다.
장내 미생물군은 진화, 신진대사, 면역 방어 및 질병 감수성에 필수적입니다123.
그러므로 인간 장에 대한 MNP의 잠재적 영향에 대해 더 연구해야 합니다.
Impaired gastrointestinal tract (GIT) function leads to disturbance in the regulation of energy homeostasis. Evidence shows that MPs and NPs can be accumulated easily in the GIT.121,122 However, the effects of MNPs on human gut microbiota, inflammation and associated mechanisms are not yet fully understood. A study by Fournier et al. (2023) evaluated the effects of Polyethylene (PE) MPs (1–10 μm) on the human gut microbiota intestinal barrier using a Mucosal Artificial Colon (M-ARCOL) model, coupled with a co-culture of Caco-2 and mucus-secreting cells.79 Exposure to PE-MPs (21 mg of MPs in 8 mL of water for 14 days) increased harmful microbes like pathobionts, Desulfovibrionaceae, and Enterobacteriaceae while reducing beneficial microbes like Christensenellaceae and Akkermansiaceae in terms of composition and metabolic activity. However, there were no significant effects on permeability and inflammation on the mucus/epithelium barrier.79 Although this study provides important information on MPs exposure effects on the human gut, the major limitation was that it only used virgin PE microbeads that are not fully representative of ingested forms based on their spherical shape.79 Moreover, whether the observed effect is due to a high dose of PE-MPs or any persistent particles is unclear. This could have been clarified by including another MP type or a different particle. Studies show that polyethylene terephthalate (PET)-MPs can undergo biotransformation in the human digestive tract and colon, altering the structure of the particles and the microbial community composition in the colon.80 A separate study indicated that PE-MPs co-exposure can exacerbate tetrabromobisphenol A (TBBPA) cytotoxicity and alter the gut microbial composition, diversity, and metabolic pathways, which may disrupt nutrient metabolism, ultimately breaking gut homeostasis.81 Genes encoding plastic-degrading enzymes were found in the human gut microbiome, indicating an adaptation of the gut microbiome to MPs pollution (Nugrahapraja et al., 2022).
In animal studies, MP exposure has also been shown to cause adverse effects on the intestinal system. Combined exposure to PS-NPs and PS-MPs (50 nm and 500 nm, respectively, at a concentration of 20 mL/kg bw for 28 days) caused intestinal barrier dysfunction by epithelial cell apoptosis though ROS production in mice model.82 In another study in mice model, exposure to PE-MPs (10–150 μm) at various concentrations (2, 20, and 200 μg/g for 5 weeks) showed more gut microbial species, increased bacterial abundance, flora diversity and increased pro-inflammatory cytokines secretion.83 The study's results suggest that exposure to PE-MPs can cause intestinal dysbacteriosis and inflammation via the TLR4 signalling pathway. The gut microbiota is vital for evolution, metabolism, immune defence, and disease susceptibility123; therefore, The potential effects of MNPs on the human gut must be studied further.
Cardiovascular system
심혈관계
MNP가 혈류로 들어가면 심혈관계에 부작용을 일으킬 수도 있습니다. 그러나 MNP 노출로 인한 심혈관 영향에 대한 정보는 제한적입니다.
최근 증거에 따르면 MP는 여러 인간 심장 조직과 혈액에 존재합니다.63
인간 세포 기반 조사에 따르면 PS-NP(40 nm 및 200 nm, 1X 농도)에 노출된 후 방실 심장 판막의 발달이 현저하게 영향을 받는 것으로 나타났습니다.
109/mL)를 인간 유도 만능 줄기 세포(hiPSC)에 24시간 동안 투여했습니다.84
MNP가 혈류를 통해 심장으로 이동하는 것이 생쥐와 쥐에서 보고되었습니다.82,98,124
예를 들어, 경구 노출(5 및 50 mg 3개월 동안 Wister 쥐를 PS-NPs(0.5 μm)로 처리한 결과 심근 세포에 NP가 축적되는 것으로 나타났습니다.124
MNP가 심장으로 전이되는 것은 입자 크기와 표면 변형에 따라 달라집니다.47
입자 크기가 460인 경우 nm 및 1 μm는 적혈구에 영향을 줄 수 있습니다.125
MNP는 심장 기능에 영향을 미치고 (미세) 혈관 부위에 독성을 일으킬 수 있습니다.126
제브라피시 배아에서 환경적으로 관련된 PS-MP 및 PP-MPS 농도는 심박수 감소를 유발했습니다.127
그러나 관련 메커니즘은 아직 정확하지 않습니다.
일부 가능한 메커니즘에는 MNP와 심장 근절의 직접적인 상호 작용 및 심박수에 대한 후속 영향114 또는 심장 세포 손상, 혈액 순환 영향 및 심장 기능 손상을 초래하는 MNP 노출에 의한 ROS 매개 산화 손상의 간접적 유도가 포함됩니다.128,129
또한 심박수에 관해서는 심박 변이도(HRV)에도 주의를 기울여야 합니다. HRV가 낮을수록 고혈압 및 죽상경화증과 관련이 있기 때문입니다.130,131
심박수 외에도 일부 연구에서는 MNP 노출이 심장 기능에 영향을 미칠 수 있음을 나타냅니다.
한 연구에서 쥐를 PS-MP(0.5 mm, 0.5~50 mg/L)에 노출시키면 미토콘드리아 완전성 손상, 크레아틴 키나제-MB 및 심장 트로포닌 수치 증가로 심장의 구조와 기능이 손상되는 것으로 나타났습니다.132
또한 PS-MPs 유발 산화 스트레스는 쥐 모델에서 Wnt/β-카테닌 경로의 활성화를 통해 심근세포 사멸을 촉진하고 심장 섬유증을 유발한다고 제안되었습니다.124
그러나 이 두 연구의 주요 한계는 단분산 폴리스티렌 구형 입자를 사용했다는 것입니다.
따라서 이러한 결과를 환경적으로 관련된 노출로 추정하는 방법이 불분명합니다.
또 다른 연구에서 MNP는 산화 스트레스, 염증, 세포사멸 및 파이롭토시스를 통해 심장 세포에 영향을 미치는 것으로 나타났습니다.
PS-MP(5 μm, 1~100 mg/L)에 닭을 6주 동안 경구 노출하면 심근 섬유 손상, 세포 염증 및 미토콘드리아 병변이 발생했습니다.88
MNP는 용혈, 혈전증, 혈액 응고 및 내피 세포 손상을 통해 미세혈관 독성을 유발할 수 있습니다.
MNP가 체외에서 인간 세포에서 용혈을 일으킬 수 있다는 증거가 있습니다.
예를 들어, 단백질이 없는 배지에서 인간 적혈구(RBC)를 PS-NP(50~250 nm; 50~500 μg/mL)로 처리하면 상당한 용혈이 발생했으며 용혈 정도는 입자 크기와 용량에 따라 달라졌습니다.
의존적입니다.85 혈전증은 심혈관 질환의 상당한 위험 요소입니다.
동물 연구에서, 표면 변형이 있는 PS 입자(60 nm, 5~500 μg/kg)에 햄스터를 노출시키면 다양한 혈전 현상이 발생했습니다.89 연구에 따르면 변형되지 않은 입자는 최대 5mg/kg bw까지 혈전증에 영향을 미치지 않는 것으로 나타났습니다.
대조적으로, 카르복실레이트-폴리스티렌 입자는 500 및 100 μg/kg bw에서 혈전 형성을 억제했지만 50 μg/kg bw에서는 억제하지 못했습니다.
반면, 아민-폴리스티렌은 50 및 500 μg/kg bw에서 혈전증을 유발했지만 5 μg/kg bw에서는 그렇지 않았습니다.89
MNP에 대한 노출은 전응고 경로와 항응고 경로 사이의 평형에 영향을 미칠 수 있습니다.
인간 혈장에서 아민-PS-NP(57 및 330 nm; 0.06-0.5 mg/mL)는 트롬빈 생성 감소 및 혈액 응고 유도를 나타냈습니다.86
인간 제대 정맥 내피 세포(HUVEC)에 PS-NP(100 및 330 nm) 노출 500 nm; 5~100 μg/mL)은 인간 제대 정맥의 내피 세포막과 상호 작용하여 내피 손상을 유발하고 자가포식소체 형성을 유도하며 내피 세포에서 자가포식 흐름 차단을 일으키는 것으로 나타났습니다.87
전반적으로 MNP에 의한 혈관 내피 손상은 다음을 초래할 수 있습니다.
내피 성장 인자의 파괴, 내피 세포와 혈액 및 면역 세포 사이의 상호 작용, 내피 기능 장애 및 염증 반응을 통한 일련의 심혈관 사건입니다.
If they enter the bloodstream, MNPs may also cause adverse effects on the cardiovascular system. However, there is limited information on the cardiovascular effects of MNPs exposure. Recent evidence shows that MPs in multiple human heart tissues and blood.63 A human cell-based investigation indicated that the development of atrioventricular heart valves was affected remarkably after exposure of PS-NPs (40 nm and 200 nm, at a concentration of 1 × 109/mL) to human-induced pluripotent stem cells (hiPSCs) for 24 h.84 The migration of MNPs through the bloodstream to the heart has been reported in mice and rats.82,98,124 For example, oral exposure (5 and 50 mg/L) of Wister rats to PS-NPs (0.5 μm) for three months showed the accumulation of NPs in the myocardial cells.124 The translocation of MNPs to the heart depends on particle size and surface modification.47 When the particle size is 460 nm and 1 μm may affect the RBCs.125
MNPs may affect cardiac functions and cause toxicity on (micro) vascular sites.126 In zebrafish embryos, environmentally relevant concentrations of PS-MPs and PP-MPS caused reduced heart rates.127 However, the associated mechanisms are not precise yet. Some possible mechanisms include the direct interaction of MNP with cardiac sarcomeres and subsequent effects on the heart rate114 or the indirect induction of ROS-mediated oxidative damage by MNP exposure that leads to heart cell damage, affected blood circulation and impaired heart function.128,129 In addition to heart rate, attention should also be given to heart rate variability (HRV), as lower HRV is associated with hypertension and atherosclerosis.130,131
Apart from heart rate, some studies indicated that MNP exposure could affect cardiac functions. In a study, the exposure of rats to PS-MPs (0.5 mm, 0.5–50 mg/L) caused damaging the heart's structure and function with impaired mitochondrial intregity and increased creatine kinase-MB and cardiac troponin I levels.132 It has also been suggested that PS-MPs-induced oxidative stress promotes cardiomyocyte apoptosis and leads to cardiac fibrosis through activation of the Wnt/β-catenin pathway in rat models.124 However, the major limitation of this two studies is that it used monodisperse polystyrene spherical particles. Therefore, it is unclear how to extrapolate these results to environmentally relevant exposures. In another study, MNPs has been shown to affect the cardiac cells through oxidative stress, inflammation, apoptosis, and pyroptosis. Oral exposure of chicken to PS-MPs (5 μm; 1–100 mg/L) for six weeks caused myocardial fibre damage, cellular inflammation, and mitochondrial lesions.88
MNPs can cause micro-vascular toxicity through hemolysis, thrombosis, blood coagulation and damaging of endothelial cells. There is evidence that MNPs can cause hemolysis in human cells in vitro. For example, in a protein-free medium, treating human red blood cells (RBCs) with PS-NPs (50–250 nm; 50–500 μg/mL) caused significant hemolysis, and the degree of hemolysis was particle size and dose-dependent.85 Thrombosis is a considerable risk factor for cardiovascular disease. In animal studies, exposure of hamsters to PS particles (60 nm; 5–500 μg/kg) with surface modifications caused different thrombotic events.89 The study showed that unmodified particles did not exert effects on thrombosis up to 5 mg/kg bw. In contrast, carboxylate-polystyrene particles inhibited thrombus formation at 500 and 100 μg/kg bw but not at 50 μg/kg bw. On the other hand, amine-polystyrene caused thrombosis at 50 and 500 μg/kg bw but not at 5 μg/kg bw.89 Exposure to MNPs can impact the equilibrium between pro- and anticoagulant pathways. In human plasma, amine-PS-NPs (57 and 330 nm; 0.06–0.5 mg/mL) showed reduced production of thrombin and induced blood coagulation.86 Exposure of human umbilical vein endothelial cells (HUVECs) with PS-NPs (100 and 500 nm; 5–100 μg/mL) showed to interact with the endothelial cell membrane of the human umbilical vein, caused endothelial damage, induced autophagosome formation and autophagic flux blockage in endothelial cells.87 Overall, vascular endothelial damage by MNPs may lead to a series of cardiovascular events through disruption in endothelial growth factor, the interaction between endothelial cells and blood and immune cells, endothelial dysfunction and inflammatory responses.
Hepatic system
간 시스템
간은 MNP를 포함한 다양한 생체이물 물질의 영향을 받는 주요 기관입니다.133
간 기능 장애는 신체의 다른 많은 기관에 영향을 미칠 수 있습니다. 지금까지 MNP가 간에 미치는 영향을 평가한 연구는 소수에 불과합니다. MP의 존재를 확인하기 위해 연구에서는 간경변 환자와 기저 간 질환이 없는 참가자의 간 조직 샘플을 조사했습니다.64
이 연구에서는 간경변 간 조직 샘플에서만 6가지 유형의 MP 중합체가 발견되었으며, 이는 만성 간 질환이 핵심일 수 있음을 시사합니다.
간 내 MP 축적의 동인입니다.64
그러나 간 질환에서 MP의 정확한 역할과 간 섬유화 및 간경변증 발생과의 관계는 명확하지 않습니다.64
시험관 내 연구에서 인간 간세포(Hep G2)를 사용하여 다양한 농도의 폴리스티렌 MP(PS-MP, 1 μm)의 독성학적 영향을 평가했습니다.41
PS-MP(100 μg/mL)에 노출되면 독성이 크게 감소했습니다.
세포 증식에는 영향을 미치지만 세포 생존력에는 유의미한 감소가 없습니다.
또한, qRT-PCR 분석에서는 해당과정에 관여하는 효소인 글리세르알데히드-3-인산탈수소효소(GAPDH), 항산화 효소인 카탈라아제(CAT) 및 슈퍼옥사이드 디스뮤타제 2(SOD2)의 유전자 발현이 감소하여 SOD2 및 SOD2의 잠재력이 감소하는 것으로 나타났습니다.
ROS를 해독하는 CAT. 이 연구의 전반적인 결과는 100 μg/mL의 1 μm PS-MP가 간에 도달하여 세포-세포 상호 작용 및 세포 대사에 변화를 일으킬 수 있음을 시사합니다.
또 다른 시험관 내 연구에서는 인간 다능성 줄기 세포(hPSC)에서 생산된 간 오가노이드(LO)를 다양한 농도의 1 μm PS-MP (0.25, 2.5 및 25 μg/mL PS-MP)에 노출시켰습니다.90
결과는 다음과 같습니다.
PS-MP는 가장 낮은 농도에서도 세포 독성(사멸 세포 증가 및 살아있는 세포 감소)을 통해 간독성 및 지방 독성을 유발할 수 있으며 분자 표지(상등액에서 AST, ALT 및 LDH 활성 증가, GST 활성, GSH 및 SOD 함량 감소)를 변경할 수 있습니다.
LO 및 산화 스트레스를 나타내는 MDA 함량 증가). PS-MP는 LO에서 지질 축적을 일으키고, ATP 생성을 감소시키고, ROS 생성을 증가시키며, 염증 마커 IL-6 및 COL1A1을 방출합니다. PS-MP는 또한 간 HNF4A 및 CYP2E1 발현을 증가시켜 간 지방증 및 섬유증의 위험을 증가시켰습니다.90
다수의 생체내 연구에서 MNP가 간에 미치는 영향을 평가했습니다. 예를 들어, 형광성 PS-MP(5 μm 및 20 μm)를 수컷 성체 쥐에게 다양한 용량(0.01~0.5 mg/일)으로 투여했습니다.91
치료받은 쥐는 간 무게 감소, 간 조직 내 PS-MP 축적, 간의 염증과 지질 방울. 노출된 쥐는 또한 ATP 수준이 감소하고 LDH 활성이 증가했으며 TC 및 TG 수준이 감소한 것으로 나타났습니다.
이는 PS-MP 노출이 에너지 대사와 간 기능에 영향을 미칠 수 있음을 시사합니다.
그러나 이 연구의 주요 제한점은 중간 대사체 수준의 변화에 대한 역경 발견을 해석하기 어렵다는 점, 특히 주장을 뒷받침하지 않는 이미지와 간의 MP 농도가 전달된 용량을 초과한다는 점입니다.134
녹색에 노출된 수컷 생쥐 형광성 MP를 60일 동안 경구 투여한 결과, 0.1 mg/L의 더 낮은 농도에서도 MP가 핵과 미토콘드리아 DNA 모두에 손상을 주어 이중 가닥 DNA 단편을 세포질로 방출할 수 있음이 나타났습니다.93
이는 STING 경로의 활성화를 촉발합니다. 간 섬유화로 이어집니다.93 추가 마우스 연구에서 PS-MP(0.5 μm)를 4주 동안 0.5 mg/일로 경구 투여하면 간의 무게와 기능 매개변수가 증가하고 NK 세포와 대식세포의 침윤이 발생하는 반면 B 세포의 침윤은 감소했습니다. 94
한 연구에서 수컷 쥐는 4주 동안 5 μm 형광 PP-MP(0.1, 0.5, 1 mg/mL)에 노출되었습니다.92
결과에 따르면 PP-MP는 미토콘드리아 크리스태를 파괴 및 감소시켜 간을 손상시킬 수 있으며, 간 효소의 활성 및 발열증, 산화 손상 및 지질 과산화를 유발합니다.92
Abdel-Zaher et al. (2023) 연구에서는 15일 동안 PE-MP 노출(100 nm, 600 μg/일)이 쥐 모델의 간 기능에 영향을 미치는 것으로 나타났습니다.135
또한, PE 마이크로비드(36 및 116 μm) 섭취(음식 100 μg/g) 6주와 9주 동안) 생쥐에서 간 섬유화의 악화가 나타났습니다.136
대부분의 연구는 MNP의 염증성 및 산화 스트레스 매개 간 손상에 중점을 두었습니다.
따라서 향후 연구에서는 MNP로 인한 간 손상의 다른 가능한 메커니즘을 조사해야 합니다.
The liver is the primary organ that is affected by various xenobiotic substances, including MNPs.133 Impaired liver function can affect many other organs in the body. Up to now, only a few studies have evaluated the effects of MNPs on the liver. To determine the presence of MPs, the research examined liver tissue samples from patients with liver cirrhosis and participants without underlying liver disease.64 The study found six types of MPs polymers only in cirrhotic hepatic tissue samples, suggesting that chronic liver disease may be a key driver in MP accumulation in the liver.64 However, the exact role of MPs in liver disease and their relation to hepatic fibrogenesis and cirrhosis development is not clear.64
In an in vitro study, human hepatocytes (Hep G2) were used to assess the toxicological impact of polystyrene MPs (PS-MPs, 1 μm) at various concentrations.41 Exposure to PS-MPs (100 μg/mL) caused a significant decrease in cell proliferation but no significant reduction in cell viability. Furthermore, qRT-PCR analysis indicated that gene expression reduced for glyceraldehyde-3-phosphate dehydrogenase (GAPDH), an enzyme involved in glycolysis, and antioxidant enzymes catalase (CAT) and superoxide dismutase 2 (SOD2), thus decreasing the potential of SOD2 and CAT in detoxifying ROS. The overall results of this study suggest that 1 um PS-MPs of 100 μg/mL reach the liver and may lead to alteration in cell–cell interactions and cell metabolism. In another in vitro study, liver organoids (LOs) produced from human pluripotent stem cells (hPSC) were exposed to different concentrations of 1 μm PS-MPs (0.25, 2.5 and 25 μg/mL PS-MP).90 The results showed that PS-MPs, even at the lowest concentration, could induce hepatotoxicity and lipotoxicity through cytotoxicity (increased apoptotic cells and decreased live cells) and alter molecular markers (increased AST, ALT and LDH activity in supernatants, decreased GST activity, GSH and SOD contents in the LOs, and increased MDA contents indicative of oxidative stress). PS-MPs caused lipid accumulation in LOs, reduced ATP production, increased ROS production, and released inflammatory markers IL-6 and COL1A1. PS-MPs also increased hepatic HNF4A and CYP2E1 expression, increasing the risk of liver steatosis and fibrosis.90
A number of in vivo studies evaluated the effects of MNPs on the liver. For example, fluorescent PS-MPs (5 μm and 20 μm) were administered to male adult mice in varying doses (0.01–0.5 mg/day).91 Treated mice showed decreased liver weight, accumulation of PS-MPs in liver tissue, and inflammation and lipid droplets in the liver. The exposed mice also showed reduced ATP levels, increased LDH activity, and lowered TC and TG levels. This suggests that PS-MPs exposure may impact energy metabolism and liver function. However, the study's major limitations are the difficulties of interpreting the finding of adversity of alterations of intermediary metabolite levels, especially the images that don't support the claims, and MP concentrations in the liver exceed the delivered dose.134 Male mice exposed to green fluorescent MPs orally for 60 days showed that even at the lower concentration of 0.1 mg/L, MPs can cause damage to both nucleus and mitochondrial DNA, releasing double-stranded DNA fragments into the cytoplasm.93 This triggers the activation of the STING pathway, leading to liver fibrosis.93 In further mouse study, oral administration of PS-MPs (0.5 μm) for 4 weeks at 0.5 mg/day increased liver weights and function parameters and caused infiltration of NK cells and macrophages while reducing that of B cells.94 In a study, male mice were exposed to 5 μm fluorescent PP-MPs (0.1, 0.5, and 1 mg/mL) for four weeks.92 Results showed that PP-MPs can damage the liver by breaking and reducing mitochondrial cristae, increasing the activity of liver enzymes and causing pyroptosis, oxidative damage, and lipid peroxidation.92 Abdel-Zaher et al. (2023) study found that PE-MPs exposure (100 nm, 600 μg/day) for 15 days impacted the liver function in a murine model.135 Further, PE microbeads (36 and 116 μm) ingestion (100 μg/g of food for 6 and 9 weeks) showed exacerbated liver fibrogenesis in mice.136 Most studies have focused on MNPs' inflammatory and oxidative stress-mediated liver injury. Therefore, future studies should explore other possible mechanisms of MNPs-induced liver damage.
Renal system
신장 시스템
신장 기능이 손상되면 혈류에 독소와 불순물이 축적되어 전반적인 건강에 부정적인 영향을 미칠 수 있습니다.
한 연구에서 MP(PVA, PVC, PP 및 PE, 4~15 μm 크기)가 사람의 소변에서 발견되었는데, 이는 MP가 위장관을 통과하여 생물학적 과정을 통해 배설될 수 있음을 시사합니다.137
Prata et al. (2023)은 MNP가 식균 작용이나 대변의 담즙 배설을 통해 간에서 주로 배설되고 소변의 생분해 산물을 통해 신장에서 배설된다는 점을 나타냈습니다.183
일부 세포 배양 및 동물 연구에서는 MNP가 신장에 미치는 잠재적 영향을 확인했습니다.
Goodman 등의 연구에서. (2022)에 따르면, 인간 배아 신장 세포(HEK 293)를 1 μm PS-MP(최대 72시간 동안 5 μg/mL)에 노출시켰습니다.41
결과는 PS-MP가 신장 세포의 유의한 형태적 변화, 흡수 및 흡수를 유발하는 것으로 나타났습니다.
PS-MP 입자의 감소 및 세포 증식 감소. 노출된 세포에서는 ROS 수준이 증가한 것으로 관찰되었습니다.41
또 다른 연구에서 연구자들은 인간의 신장(HK-2)과 고환(NTE) 세포를 형광 표지된 PS-NP(50 nm, 200 μg/mL, 24시간 동안)에 노출시켰으며 다음과 같은 사실을 발견했습니다.
PS-NP는 세포내이입을 통해 세포로 들어갈 수 있으며, 이는 세포 미세구조에 손상을 일으키고 JNK1/2/3 및 TNF-α.95의 발현을 증가시킵니다.
Wang et al. (2021)은 인간 HK-2 세포에 대한 PS-MP(2μm)의 효과를 조사했습니다.96
이 연구에서는 PS-MP 노출(2시간 동안 0.025~0.8 μg/mL)이 ROS와 미토콘드리아 단백질의 증가를 유발한다는 사실이 밝혀졌습니다.
ER 스트레스, 염증 표지자, 단백질 LC3 및 Beclin 1뿐만 아니라 나쁜 수준. 또한 PS-MP는 MAPK 및 AKT/mTOR 신호 전달 경로에 영향을 미쳤습니다.96
여러 연구에서 MNP가 동물의 신장에 미치는 영향을 조사했습니다. Meng 등이 실시한 연구 중 하나입니다.
(2022)에서는 수컷 생쥐에 PS-MP(300nm, 600nm, 4μm) 및 PS-NP(50nm)를 5mg 농도의 물과 함께 24시간 및 4주 동안 사용하여 체중 감량을 유도했습니다.
사망률 증가, 바이오마커 변경 및 신장의 조직학적 손상.97
이 연구는 또한 신장에서 MP 및 NP의 생물학적 축적을 발견했으며, 600 nm 입자는 독성을 악화시켰습니다.
또한 PS-NP와 PS-MP는 산화 스트레스와 염증을 유발합니다.
추가 연구에서 마우스를 다양한 농도의 5 μm 및 20 μm 형광 PS-MP에 노출시켰으며 그 결과 신장에서 강한 형광 발현과 지질 대사 장애가 나타났습니다.91
그러나 이 연구에는 문헌에 언급된 몇 가지 제한 사항이 있었습니다. 간 시스템 섹션.
Impairment of kidney function can result in the accumulation of toxins and impurities in the bloodstream, which can adversely affect overall health. In a study MPs (PVA, PVC, PP and PE, 4–15 μm size) were found in human urine, suggesting that they can pass through the gastrointestinal tract and be excreted through biological processes.137 A review by Prata et al. (2023) indicated that MNPs are mainly excreted by the liver via phagocytosis or biliary excretion in faeces and the kidney via biodegradation products in urine.138
Some cell cultures and animal studies determined the potential effects of MNPs on kidneys. In a study by Goodman et al. (2022), human embryonic kidney cells (HEK 293) were exposed to 1 μm PS-MPs (5 μg/mL for up to 72 h).41 The results showed that PS-MPs caused significant morphological changes in the kidney cells, uptake of PS-MP particles, and reduced cell proliferation. The exposed cells observed increased ROS levels.41 In another study, researchers exposed human kidney (HK-2) and testis (NTE) cells to fluorescent-labelled PS-NPs (50 nm, 200 μg/mL for 24 h) and found that the PS-NPs can enter the cells through endocytosis, causing damage to cellular microstructures and an increase in the expression of JNK1/2/3 and TNF-α.95 Wang et al. (2021) explored the effects of PS-MPs (2 μm) on human HK-2 cells.96 The study revealed that PS-MP exposure (0.025–0.8 μg/mL for 2 h), caused an increase in ROS and mitochondrial protein Bad levels, as well as ER stress, inflammatory markers, and proteins LC3 and Beclin 1. Furthermore, PS-MPs impacted the MAPK and AKT/mTOR signalling pathways.96
Several studies have investigated the impact of MNPs on kidneys in animals. One such study conducted by Meng et al. (2022) involved the use of PS-MPs (300 nm, 600 nm, 4 μm) and PS-NPs (50 nm) on male mice at a concentration of 5 mg with water for 24 h and 4 weeks, resulting in weight loss, increased death rates, altered biomarkers, and histological damage to the kidney.97 The study also found bioaccumulation of MPs and NPs in the kidneys, with the 600 nm particles causing exacerbated toxicity. Moreover, PS-NPs and PS-MPs cause oxidative stress and inflammation. In a further study, mice were exposed to various concentrations of 5 μm and 20 μm fluorescent PS-MPs, and the results indicated a strong fluorescence expression in the kidneys and disturbance in lipid metabolism.91 However, the study had some limitations mentioned in the hepatic system section.
Reproductive and developmental system
Some animal studies have reported on the reproductive and developmental toxicity of MNPs,99,100 but still, there is limited information for humans. A study in China found 16 types of MPs in placentas and meconium samples, with polyamide and polyurethane being the major types.139 MPs were detected in about 76.5% of the samples with a size of 20–50 μm. The major microbiota found were Proteobacteria, Bacteroidota, and Firmicutes. The study also indicated an inverse correlation between polyethylene and the Chao index of meconium microbiota and several genera of placenta microbiota.139 Xiao et al. (2023) found that PS-NPs (50 nm) can enter testis cells through endocytosis and impact micro-structures.95 Dysregulated proteins were found on cancer signalling pathways such as PI3K-AKT and MAPK. The activated PI3K-AKT pathway plays a significant role in sperm cell proliferation, survival, and testicular growth.95 Moreover, it facilitates the interaction between FSH and support cells, which helps in maintaining testicular stability in males.140
Studies have shown that exposure to PS-MPs can cause reproductive toxicity in mice. For example, exposure to PS-MPs (5.0–5.9 μm) in male-female mice caused testis and ovarian damage, oxidative stress, hormonal changes, and reproductive issues.99 Furthermore, decreased pregnancy rate and fewer embryos were observed after PS-MPs exposure. Female mice showed greater susceptibility to MPs exposure than male mice.99 In female mice, PS-MPs exposure was shown to cause inflammation of ovaries and decrease the quality of oocytes in mice, which indicates reproductive toxicity.98 In a separate study, male mice exposed to PS-MPs (5.0–5.9 μm) in saline solution for six weeks had reduced sperm count and motility, increased sperm deformity rate, and lower serum testosterone levels. MNPs may also disrupt energy balance and cause reproductive toxicity. However, it’s unclear if the effects on testicular function are directly caused by exposure to the test materials since testicular histology wasn't analyzed.141 The effects on sperm may also be due to epididymis defects.
Nervous system
생식 및 발달 시스템
일부 동물 연구에서는 MNP의 생식 및 발달 독성에 대해 보고했지만99,100 여전히 인간에 대한 정보는 제한적입니다. 중국의 한 연구에서는 태반과 태변 샘플에서 16가지 유형의 MP가 발견되었으며, 폴리아미드와 폴리우레탄이 주요 유형입니다.139
MP는 20~50 μm 크기의 샘플 중 약 76.5%에서 검출되었습니다.
발견된 주요 미생물군은 프로테오박테리아(Proteobacteria), 박테로이도타(Bacteroidota), 페르미쿠테스(Firmicutes)였습니다.
이 연구는 또한 폴리에틸렌과 태변 미생물총의 Chao 지수와 태반 미생물총의 여러 속 사이의 역상관관계를 나타냈습니다.139
Xiao et al. (2023)은 PS-NP(50 nm)가 세포내이입을 통해 고환 세포에 들어가 미세 구조에 영향을 미칠 수 있음을 발견했습니다.95
조절 장애가 있는 단백질은 PI3K-AKT 및 MAPK와 같은 암 신호 전달 경로에서 발견되었습니다. 활성화된 PI3K-AKT 경로는 정자 세포 증식, 생존 및 고환 성장에 중요한 역할을 합니다.95 또한 FSH와 지지 세포 사이의 상호 작용을 촉진하여 남성의 고환 안정성을 유지하는 데 도움이 됩니다.140
연구에 따르면 PS-MP에 노출되면 생쥐에게 생식 독성이 발생할 수 있는 것으로 나타났습니다. 예를 들어 수컷-암컷 생쥐에서 PS-MP(5.0~5.9 μm)에 노출되면 고환 및 난소 손상, 산화 스트레스, 호르몬 변화 및 생식 문제가 발생했습니다.99
또한 PS-MP 후에 임신율이 감소하고 배아 수가 더 적었습니다. 노출. 암컷 생쥐는 수컷 생쥐보다 MPs 노출에 더 큰 민감성을 보였습니다.99
암컷 생쥐에서 PS-MPs 노출은 난소 염증을 일으키고 생쥐의 난모세포의 질을 저하시키는 것으로 나타났습니다.
이는 생식 독성을 나타냅니다.98
별도의 연구에서 수컷 생쥐 6주 동안 식염수에 담긴 PS-MP(5.0~5.9 μm)에 노출되면 정자 수와 운동성이 감소하고 정자 기형률이 증가하며 혈청 테스토스테론 수치가 낮아졌습니다.
MNP는 또한 에너지 균형을 방해하고 생식 독성을 유발할 수 있습니다.
그러나 고환 조직학이 분석되지 않았기 때문에 고환 기능에 대한 영향이 시험 물질에 대한 노출로 인해 직접적으로 발생하는지 여부는 불분명합니다.141
정자에 대한 영향은 부고환 결함으로 인한 것일 수도 있습니다.
The central nervous system in humans is highly susceptible to environmental pollutants, especially during embryonic development.142 Therefore, Exposure to micro- and nanoplastics can induce oxidative stress, which may cause cellular damage and increase vulnerability to neuronal disorders.143 Due to their size, MNPs can cause stronger neurotoxicity than MPs.144 Exposure to MPs can affect the central nervous system by influencing acetylcholine, γ-aminobutyric acid, and glutamate.145 Impaired AChE activity can lead to excessive accumulation of acetylcholine, triggering neurological disorders.146
Hua et al. (2022) studied the effects of PS-MPs (1 μm and 10 μm, 5, 50 and 100 μg/mL for 4–10 days and 4–30 days) on the human brain using a 3D model of cortical spheroids.101 Short-term exposure promoted cell proliferation and gene expression of Nestin, ATF4, PAX6, SOD2, and HOXB4, but long-term exposure decreased cell viability. PS-MPs also affected gene expression of DNA damage and neural tissue patterning.101 Neural progenitor cells are likely to uptake and internalize MP 1 μm through processes such as phagocytosis or endocytosis.147
In an animal study, male mice were orally exposed to fluorescent PS-MPs (5 μm and 20 μm) showed reduced AchE activity,91 altering cholinergic neurotransmission efficiency,148 and causing neurotoxicity and oxidative stress.91 MPs exposure caused the elevation of serum levels of threonine, aspartate and taurine while reducing phenylalanine, a precursor to neurotransmitters. Despite insufficient evidence, further investigation is needed due to the potential risks of MNPs on the nervous system.
Immune system
면역 체계
독소에 대한 노출은 전파에 따라 국소 또는 전신 면역 반응을 유발할 수 있습니다. 그러나 유전적 감수성의 경우 환경 노출만으로도 면역체계의 정상적인 기능이 손상되어 면역억제나 자가면역질환이 발생할 수 있습니다.149
MP에 노출되면 면역 세포는 사이토카인 방출에 대한 효소 수준의 전사 수준에서 강력한 조절을 유발합니다. MP가 노출되면 면역 세포는 효소 수준 및 사이토카인 방출을 포함한 다양한 전사 수준에 상당한 변화를 일으킵니다.
Lehner 등이 실시한 연구 (2020)은 인간 장 상피 세포주 Caco-2 및 HT29-MTX-E12와 인간 수지상 세포 및 혈액 단핵구 유래 대식세포로 구성된 시험관 내 3D 장 모델을 개발하여 섭취된 MP의 잠재적인 효과를 조사했습니다.
823.5~1380.0 μg/cm2 농도의 타이어 마모 및 폴리올레핀을 나타내는 500μm MP 폴리머.102
결과에서 염증성 사이토카인 수준(IL-8, TNFα 및 IL-1β)과 장벽 무결성에 일부 변화가 나타났지만 이러한 변화는 그렇지 않았습니다. 유의미합니다.102
또 다른 in vitro 연구에서는 인간 기관지 상피 세포(BEAS-2B)와 마우스 대식세포(RAW 264.7)가 60 nm PS-NP에 노출되었으며 높은 독성과 자가포식 세포 사멸을 보여주었습니다.
NH2-PS는 자가포식 플럭스를 유발하고 Akt/mTOR 및 AMPK 경로를 통해 자가포식 세포 사멸 과정을 활성화했습니다.105
Han et al. (2020)은 폴리염화비닐(PVC)과 아크릴로니트릴 부타디엔 스티렌(ABS)에 4~5일 동안 노출되면 인간 면역 세포에서 면역 반응이 발생한다는 사실을 발견했습니다.103
이 연구에서는 PVC와 ABS 모두 히스타민 방출을 억제하면서 히스타민 방출을 증가시키는 것으로 나타났습니다.
IL-6 및 TNF-α. 그러나 장기간 노출되면 면역 반응이 더 높아질 수 있는데, 이 연구에서는 이에 대해 조사하지 않았습니다.103
MP의 다른 형태인 폴리프로필렌 MP(PP-MP, 크기 ~20 μm 및 25~200 μm)는 국소 면역을 유도하는 것으로 나타났습니다. 크기와 농도에 따라 IL-6, TNF 알파, 히스타민과 같은 전염증성 사이토카인의 생성을 촉발하여 반응합니다.104
생쥐 모델에서 고농도(600 μg/일)의 PE-MP(10~150 μm)는 장내 미생물의 다양성과 구성을 변경하고 TLR4, AP-1 및 IRF5의 발현 증가를 통해 염증 반응을 일으켰습니다.83 IL-1α의 혈청 수준도 유의하게 상승했으며 CD4+ T 세포의 Th17 및 Treg 세포는 MP 노출 후 감소했습니다.83
MNP가 면역 체계에 미치는 영향에 대한 일부 증거가 있지만 대부분의 연구는 오로지 다음에만 초점을 맞췄습니다. 선천적 면역 반응. 적응 면역 반응에 대한 MNP의 영향은 아직 잘 알려져 있지 않습니다.
Exposure to toxins may induce local or systemic immune reactions based on their dissemination. However, in the case of genetic susceptibility, only environmental exposure may impair the normal function of the immune system, favouring immunosuppression or autoimmune diseases.149
Upon MP exposure, immune cells cause strong modulation at the transcriptional level of enzyme levels to the release of cytokines. When MPs are exposed, immune cells cause significant changes in various transcriptional levels, including enzyme levels and the release of cytokines. A study conducted by Lehner et al. (2020) developed an in vitro 3D intestinal model comprising human intestinal epithelial cell lines Caco-2 and HT29-MTX-E12, along with human dendritic cells and blood monocyte-derived macrophages to investigate the potential effects of ingested MPs, such as 50–500 μm MP polymer representing tire wear and polyolefins at concentration 823.5–1380.0 μg/cm2.102 Although the results showed some changes in inflammatory cytokine levels (IL-8, TNFα, and IL-1β) and the barrier integrity, these changes were not significant.102 In another in vitro study, human bronchial epithelial cells (BEAS-2B) and mouse macrophages (RAW 264.7) were exposed to 60 nm PS-NPs, and showed high toxicity and autophagic cell death. NH2-PS caused autophagic flux and activated the autophagic cell death process via Akt/mTOR and AMPK pathways.105 Han et al. (2020) found that exposure to polyvinyl chloride (PVC) and acrylonitrile butadiene styrene (ABS) for 4–5 days caused an immune response in human immune cells.103 The study showed that both PVC and ABS suppressed histamine release while increasing the release of IL-6 and TNF-α. However, long-term exposure could lead to a higher immune response, which the study has not investigated.103 Other form of MPs, polypropylene MPs (PP-MPs, size ∼20 μm and 25–200 μm) were shown to induce local immune responses by triggering the production of pro-inflammatory cytokines such as IL-6, TNF alpha, and histamine in a size and concentration-dependent manner.104
In the mice model, high concentrations (600 μg/day) of PE-MPs (10–150 μm) altered the diversity and composition of intestinal microflora and caused inflammatory reactions through increased expression of TLR4, AP-1, and IRF5.83 The serum level of IL-1α was also elevated significantly, and Th17 and Treg cells in CD4+ T cells were decreased after MPs exposure.83 While there is some evidence of the effects of MNPs on the immune system, most of the studies have focused solely on the innate immune response. The impact of MNPs on the adaptive immune response remains poorly understood.
Endocrine system
내분비 계
비스페놀 A(BPA) 및 프탈레이트와 같은 MP에서 발견되는 다양한 성분은 내분비 교란 화합물(EDC)로 간주됩니다.
이러한 EDC는 잠재적으로 내분비계의 정상적인 기능을 손상시킬 수 있습니다.
EDC는 신체에 유입되어 작용제 또는 길항제로서 호르몬 균형에 영향을 미쳐 주산기와 같은 중요한 발달 단계에서 신경내분비 효과를 일으킬 수 있습니다.150
한 연구에서는 PS-MP(0.1 g/L)가 데카브롬화 디페닐 에테르(BDE-209)를 변경할 수 있음이 입증되었습니다. )
분해 경로를 억제하고 수생생물에서 내분비계와 갑상선의 독성을 강화합니다.151
생체 내 연구에서 BPA의 단일 용량(10μg/kg)은 혈장 인슐린의 급속한 상승을 유발하여 결과적으로 혈당을 감소시켰습니다.152
보고서에서 프탈레이트와 같은 다른 EDC와 BPA를 함께 사용하면153,154 제2형 당뇨병 발병 위험이 증가할 수 있다는 사실이 밝혀졌습니다.
Jin 등의 연구. (2021)은 PS-MP(0.5 μm, 4 μm 및 10 μm) 노출(10mg/mL, 28일 동안 경구 위관 영양법을 통해)이 수컷 쥐의 테스토스테론 수치를 감소시키고 고환 장벽106에서 고환 염증을 일으키며 혈액 순환을 방해할 수 있다고 보고했습니다.
Various components found in MPs, such as Bisphenol A (BPA) and phthalates, are considered endocrine-disrupting compounds (EDCs). These EDCs can potentially impair the endocrine system's normal function. EDCs can enter the body and affect hormonal balance as agonists or antagonists, causing neuroendocrine effects during critical developmental stages like the perinatal period.150 A study demonstrated that PS-MPs (0.1 g/L) can alter the decabrominated diphenyl ether (BDE-209) degradation pathways and enhance the toxicity of the endocrine system and thyroid gland in aquatic organisms.151 In an in vivo study, a single dose of BPA (10 μg⁄kg) caused a rapid elevation in plasma insulin and consequently reduced glycaemia.152 Reports have shown that BPA with other EDCs, such as phthalates,153,154 may increase the risk of developing type 2 diabetes. A study by Jin et al. (2021) reported that PS-MP (0.5 μm, 4 μm, and 10 μm) exposure (10 mg/mL, via oral gavage for 28 days) can decline testosterone levels in male mice, cause testicular inflammation, and disrupt the blood-testis barrier.106
Muscular system
근육 체계
다른 기관과 비교하여 MNP가 근육계에 미치는 영향을 평가한 연구는 거의 없습니다.
지금까지 인간 근육 조직에 MNP가 축적되었다는 직접적인 증거는 없습니다. 한 연구에서는 생선155,156 및 기타 해산물 섭취로 인해 북부 풀마어의 근육 조직에 MP가 축적되는 것으로 나타났습니다.157
그러나 근육 손상과의 유의미한 상관관계는 관찰되지 않았습니다.155,156
마우스 모델을 대상으로 한 연구에서는 PS-MP가 (1-10 μm 및 50-100 μm) 노출은 근육 섬유 재생과 근원성 및 지방 생성 분화 사이의 균형을 방해했습니다. 또한 PS-MP 노출은 위성 세포에서 ROS의 과잉 생산을 유도하고 p38 MAPK 및 NF-κB 경로를 변경했습니다. 107
Compared to other organs, few studies have assessed the effects of MNPs on the muscular system. Until now, there is no direct evidence of the accumulation of MNPs in human muscle tissue. A study indicated the accumulation of MPs in the muscle tissue of northern fulmars due to the consumption of fish155,156 and other seafood.157 However, no significant correlation with muscle damage was observed.155,156 A study in a mouse model showed that PS-MPs (1–10 μm and 50–100 μm) exposure disrupted muscle fibre regeneration and the balance between myogenic and adipogenic differentiation.107 Furthermore, PS-MPs exposure induced the overproduction of ROS in satellite cells and altered the p38 MAPK and NF-κB pathways.107
Other effects
다른 효과
특정 기관에 미치는 영향 외에도 MNP는 생화학적, 대사적, 유전독성 및 발암성 영향을 일으킬 수 있습니다.
앞서 논의한 것처럼 MNP는 장 염증과 간 기능 장애를 일으킬 수 있습니다.
그러나 장과 간의 손상과 염증이 심각한 질병 발병으로 이어질 수 있는지는 잘 알려져 있지 않습니다.
최근 연구에서 작은 MP(직경 1μm, 음용수 10,000 μg/L)로 치료한 쥐는 공복 혈당과 인슐린 수치가 증가한 것으로 나타났습니다.
이는 간과 장 대사 사이의 혼선이 발생하여 인슐린 저항성과 당뇨병 발병으로 이어졌습니다.158
이러한 결과는 MP 노출 후 인슐린 저항성을 평가하기 위한 보다 광범위한 코호트 연구가 필요함을 시사합니다.
별도의 연구에서는 포피에서 유래한 Hs27 세포주를 구형 PS-NP(100 nm)에 노출시켰습니다.159
그 결과 DNA 손상이 유발되어 핵눈과 소핵의 형성이 증가한 것으로 나타났습니다.159
In addition to specific organ effects, MNPs can cause biochemical, metabolic, genotoxic, and carcinogenic effects. As discussed earlier, MNPs can cause intestinal inflammation and liver dysfunction. However, it is not well understood whether damage and inflammation in the gut and liver may lead to severe disease development. In a recent study, mice treated with small MPs (1 μm in diameter, 10,000 μg/L in drinking water) showed an increased level of fasting blood glucose and insulin, suggesting a crosstalk between the liver and gut metabolism, which caused insulin resistance and led to the development of diabetes.158 These results suggest a more extensive cohort study to assess insulin resistance after MPs exposure. In a separate study, Hs27 cell lines derived from the foreskin were exposed to spherical PS-NPs (100 nm).159 The results showed that DNA damage was induced, resulting in an increased formation of nuclear buds and micronuclei.159
Toxicity mechanisms of MNPs
MNP의 독성 메커니즘
MNP의 가능한 독성 메커니즘에는 세포막 파괴, 세포 기공 방해, ROS 생성, DNA 손상, 리소좀 불안정화 및 미토콘드리아 탈분극이 포함됩니다.160
MNP는 신체에 들어가면 먼저 폐 및 GIT 시스템과 접촉하고 생물학적 장벽에 직면합니다. 여러 장기로 옮겨져 전신 독성을 유발합니다.
MNP의 독성 메커니즘은 주로 입자의 물리화학적 특성과 노출된 세포 유형에 따라 달라집니다.105,161,162
다양한 플라스틱 중에서 폴리스티렌은 광범위하게 연구되었으며 양성(예: NH2) 또는 음성(예: COOH) 표면 그룹으로 기능화되었으며 독성에 약간의 변화가 있습니다.
NH2로 기능화된 PS-NP는 약물 전달에 일반적으로 사용되며 혈액뇌관문을 통과할 수 있습니다.163
NH2의 양전하는 지질층 두께를 감소시켜 PS-NH2가 세포로 들어가기를 더 쉽게 만듭니다.164,165
어떤 경우에는 단백질 대관식이 혈청/소화액은 손상으로부터 세포를 보호하고 대식세포 매개 세포 흡수에 영향을 줄 수 있습니다.164,166
연구에 따르면 500 nm 이하 크기의 PS-NH2 나노입자는 미세음세포증 및 식균작용과 같은 에너지 관련 메커니즘을 사용하여 다양한 세포에 빠르게 내부화됩니다.17
NH2 -PS-NP는 리소좀에 내부화되고, NH2 그룹은 리소좀 구획 산성화를 방해하는 "양성자 스펀지" 역할을 합니다. 이로 인해 과도한 양성자 펌프 활동이 발생하고 이온과 물이 리소좀으로 유입되어 리소좀 막이 확장되어 손상을 입게 됩니다.162,167,168
궁극적으로 리소좀의 내용물이 세포질로 방출되어 ROS 및 리소좀 프로테아제 카텝신 매개 세포사멸 세포 사멸을 유발하는 손상.162,167,168
ROS 매개 손상은 또한 자가포식 세포 사멸을 유도할 수 있습니다.105
이러한 부작용은 HeLa, 섬유아세포 폐 및 폐 세포, 장 세포와 같은 다양한 세포 유형에서 낮은 농도(5~20 μg mL−1)에서 빠르게 발생할 수 있습니다. 105,169
입자 크기에 관계없이 표면 NH2도 세포 사멸에 잠재적인 역할을 할 수 있습니다. 그러나 600 nm 이상의 PS-NH2 입자는 세포 내재화 후에 낮은 독성을 유발하는 것으로 나타났습니다.170
음이온성 비변형 PS-MNP 또는 카르복실 기능화된 PS-MNP와 같은 PS MNP는 독성을 유발할 수 있습니다.171
200 nm 이하의 음이온성 플라스틱 입자는 일반적으로 간, 폐, 장 및 대식세포에 의한 세포내이입을 통해 내부화됩니다.74,166,172,173
10 μm 크기는 일반적으로 리소좀에 위치하지만,105,174 크기가 50 nm인 입자는 장 기저측 세포 핵에 위치하는 경향이 있으며172 20 nm PS-COOH는 간 세포 미토콘드리아에 위치합니다.173
양이온성 PS와 달리 음이온성 PS는 20 nm PS-COOH의 40 μg/mL에서 약간의 팽창과 효소 활성 감소를 제외하고는 리소좀을 크게 불안정화하지 않습니다.174,175
PS의 농도가 낮을수록 다양한 세포 유형에서 세포 스트레스 지표를 유발하는 것으로 밝혀졌습니다. 예를 들어 뇌(0.05 μg mL-1) 및 HeLa 세포(10 μg mL-1)의 과도한 ROS 생성과 PS 500 nm-6 μm 노출 시 Caco-2 세포의 미토콘드리아 탈분극이 있습니다.177,178
PS-MNP는 장, 폐 및 뇌에 염증을 유발합니다.74,75,102,166
이 입자는 또한 일부 세포에서 유전독성 및 과도한 ROS 생산 관련 DNA 손상을 일으킬 수 있습니다.166
음이온성 PS-NP는 다음과 같은 다층 단백질 코로나를 형성할 수 있습니다. 단백질 형태를 변경하고 포유류 혈액 세포의 세포 독성 및 유전 독성 효과를 증가시킵니다.179
단백질 코로나는 IL-8 및 MCP-1과 같은 염증 유발 단백질을 크게 방출할 수도 있습니다.164,180
PS-MNP와 달리 다른 유형의 MNP에 대한 연구는 폴리프로필렌, 폴리에틸렌 MP와 같은 물질은 제한되어 있습니다.176,181
동물 연구에서는 인간에서 관찰된 것과 동일한 일부 독성 및 관련 메커니즘이 발견되었습니다. 예를 들어, ≥25 μg mL-1의 500 nm PS NP는 배아 독성이 증가한 반면, 100 μg mL-1의 50 nm PS NP는 생쥐의 섬유아세포에 독성을 유발하지 않았습니다.182
무척추 동물 모델에서 PS-NP에 노출되면 과도한 ROS 생성 및 세포 사멸과 같은 유사한 효과가 나타났습니다. 예를 들어 PS-NP 노출은 다양한 동물 모델에서 과도한 ROS 생성 및 세포 사멸을 초래했습니다. PET-NP는 제브라피시 배아의 미토콘드리아 완전성과 관련 경로를 방해하는 것으로 밝혀졌습니다.
MNP 노출이 장기, 특히 인간에 미치는 장기적인 영향을 이해하려면 추가 연구가 필요합니다.
MNP 독성의 증거에도 불구하고 생체 내 독성 데이터는 특히 인간에서 부족합니다. 세포, 조직 기반 및 장기 기관에 미치는 영향을 이해하려면 추가 연구가 필요합니다.
The possible toxicity mechanisms of MNPs include cell membrane disruption, cell pore hindrance, ROS production, DNA damage, lysosome destabilization, and mitochondrial depolarization.160 Upon entering the body, MNPs first come into contact with the lungs and GIT systems, encounter biological barriers, translocate to multiple organs, and cause systemic toxicities. MNPs toxicity mechanisms mainly depend on the physiochemical properties of the particle and exposed cell types.105,161,162
Of different plastics, polystyrene is extensively studied and is functionalized with either positive (e.g., NH2) or negative (e.g., COOH) surface groups and shows some variation in toxicity. NH2-functionalized PS-NPs are commonly used for drug delivery and can cross the blood–brain barrier.163 Positive charges of NH2 reduce lipid layer thickness, making it easier for PS-NH2 to enter cells.164,165 In some cases, protein coronation by blood serum/digestive fluids can protect cells from damage and affect macrophage-mediated cellular uptake.164,166 Studies demonstrated that PS-NH2 nanoparticles of size ≤500 nm are rapidly internalized in various cells using energy-related mechanisms like micropinocytosis and phagocytosis.17 When NH2-PS-NP gets internalized in lysosomes, the NH2 group acts as a “proton sponge” that hinders the lysosomal compartment acidification. This leads to excessive proton pump activity and the influx of ions and water into the lysosome, causing the lysosomal membrane to dilate and suffer damage.162,167,168 Ultimately, the contents of the lysosome are released into the cytosol, leading to ROS and lysosomal proteases cathepsins mediated damage that cause apoptotic cell death.162,167,168 ROS-mediated damage can also induce autophagic cell death.105 These adverse effects may occur rapidly at low concentrations (5–20 μg mL−1) in various cell types such as HeLa, fibroblast lung, and intestinal cells.105,169 Regardless size of the particle, the surface NH2 may also play a potential role in cellular death; however, PS-NH2 particles with ≥600 nm have been shown to cause low toxicity after cellular internalization.170
PS MNPs, such as anionic unmodified or carboxyl-functionalized PS-MNPs, can cause toxicity.171 Anionic plastic particles ≤200 nm are typically internalized through endocytosis by hepatic, lung, intestinal and macrophages.74,166,172,173 On the other hand, anionic PS with ≤10 μm in size are normally localized to lysosomes,105,174 but particles with 50 nm in size trend to localize in the intestine basolateral cells nuclei172 and 20 nm PS-COOH localize to hepatic cells mitochondria.173
Unlike cationic PS, anionic PS does not destabilize lysosomes significantly, except for slight dilation and reduced enzyme activity at 40 μg/mL of 20 nm PS-COOH.174,175 Lower concentrations of PS have been found to cause markers of cellular stress in different cell types, such as excess ROS generation in brain (at 0.05 μg mL-1) and HeLa cells (at 10 μg mL-1)176 and upon PS 500 nm- 6 μm exposure mitochondrial depolarization in Caco-2 cells.177,178
PS-MNPs cause inflammation in the intestine, lung, and brain.74,75,102,166 These particles can also cause genotoxicity and excess ROS production-related DNA damage in some cells.166 Anionic PS-NPs can form a multi-layer protein corona that can alter protein conformation and increase the cytotoxic and genotoxic effects in mammalian blood cells.179 The protein corona may also significantly release pro-inflammatory proteins like IL-8 and MCP-1.164,180 In contrast to PS-MNPs, research on other types of MNPs, such as polypropylene and polyethylene MPs, is limited.176,181
In animal studies, some identical toxicities and related mechanisms were noticed as observed in humans. For example, 500 nm PS NPs at ≥25 μg mL-1 showed increased embryotoxicity, while 50 nm PS NPs at 100 μg mL-1 did not cause toxicity on fibroblast cells in mice.182 In invertebrate animal models, exposure to PS-NPs resulted in similar effects like excess ROS generation and cellular death.183, 184, 185 For example, PS-NPs exposure led to excess ROS generation and cellular death in various animal models. PET-NPs were found to disrupt mitochondrial integrity and related pathways in zebrafish embryos. Further research is required to understand the long-term effects of MNPs exposure on organs, especially in humans. Despite evidence of MNPs toxicity, in vivo, toxicity data is lacking, particularly in humans. Further research is needed to understand cellular, tissue-based, and long-term organ effects.
Outstanding questions
미해결 질문
MNP가 인간 장기 시스템에 미치는 유해한 영향에 대한 징후에도 불구하고 몇 가지 지식 격차가 남아 있습니다. 예를 들어 현재 MP와 NP를 정의하고 탐지하는 표준화된 방법이 부족합니다. 따라서 크기, 형태, 물리적, 화학적 특성, 출처 등 여러 기준을 고려하여 플라스틱 쓰레기에 대한 고유한 정의와 분류를 확립하는 것이 필요합니다. 또한 생물학적 시료에서 MP와 NP를 검출하고 정량화하기 위해서는 표준 방법과 샘플링 절차를 개발해야 합니다.
독성학 연구에서는 환경에 실제로 존재하는 것과 다른 플라스틱을 사용하므로 정확한 결과를 얻는 것이 어렵습니다. 연구는 주로 폴리스티렌 MP에 초점을 맞추고 있지만 다른 형태의 MP도 환경에 존재합니다. 향후 연구에서는 잠재적인 건강 위험을 확인하기 위해 다른 형태의 MP와 환경적으로 관련된 농도를 고려해야 합니다.
MNP와 관련하여 어떤 노출 경로가 인간에게 가장 심각한 위험을 초래하는지는 불분명합니다. 또한 인체에서 MNP를 제거하는 과정에 대한 정보가 부족합니다. 또한 MNP가 인간에 노출되는 동안 특정 화학 물질이나 미생물과 상호 작용하는 친화력이 있는지 조사하는 것이 중요합니다.
인간에서 MNP의 독성 메커니즘은 다른 오염물질과의 상호작용을 포함하여 완전히 이해되지 않았습니다. MNP가 인간 건강에 미치는 장기적인 영향은 불분명하며 개인의 민감성도 알려져 있지 않습니다. 또한 MNP 노출의 특정 종 독성은 잘 알려져 있지 않습니다. 따라서 인간 건강 위험 평가는 제한적이고 어렵습니다. 동물 및 세포 연구는 부작용을 이해하는 데 도움이 될 수 있지만, 깊은 통찰력을 얻으려면 관찰 및 바이오마커 기반 연구가 필요합니다. 정확한 관찰 연구를 위해서는 연령, 성별, 직업, 거주지, 영양 상태, 동반 질환 등 알려진 잠재적 혼란 변수를 조정하는 것이 중요합니다. 이를 달성하려면 노출된 그룹과 노출되지 않은 그룹 모두 동일한 소스 모집단에서 선택해야 합니다. 또한, 결과가 대표성이 있고 더 많은 모집단에 일반화될 수 있도록 하려면 대규모 표본을 얻는 것이 필수적입니다. 또한 조사자는 여러 결과를 동시에 조사하도록 선택할 수도 있습니다. 더욱이, 미래 연구는 이 문제를 해결하기 위해 다학문적 접근 방식을 통합해야 합니다.
- Despite indications of the harmful effects of MNPs on human organ systems, several knowledge gaps remain. For example, there is currently a lack of standardized methods for defining and detecting MPs and NPs. Therefore, it is necessary to establish a unique definition and classification of plastic debris, taking into account several criteria such as size, shape, physical and chemical properties, and sources. In addition, standard methods and sampling procedures need to be developed to detect and quantify MPs and NPs in biological specimens.
-
- Toxicological studies use plastics that differ from their realistic presence in the environment, making it challenging to get accurate results. Research mainly focuses on polystyrene MPs, but other forms of MPs are also present in the environment. Future studies should consider other forms of MPs and environmentally relevant concentrations to determine potential health risks.
-
- It remains unclear which route of exposure poses the most significant risk for humans regarding MNPs. Additionally, the elimination process of MNPs from the human body lacks sufficient information. Furthermore, it is important to investigate whether MNPs have an affinity to interact with specific chemicals or microorganisms during human exposure.
-
- The toxicity mechanisms of MNPs in humans are not fully understood, including their interactions with other pollutants. The long-term effects of MNPs on human health are unclear, with individual susceptibility unknown. In addition, the specific species toxicity of MNPs exposure is poorly understood. Therefore, human health risk assessment is limited and challenging. Animal and cell studies can help understand adverse effects, while observational and biomarker-based studies are needed to get deep insights. To ensure accurate observational studies, it is crucial to adjust potential confounders that are known such as such as age, sex, occupation, living place, nutritional status, and comorbidity. To achieve this, both the exposed and unexposed groups should be selected from the same source population. Furthermore, obtaining a large sample is essential to ensure the findings are representative and can be generalized to a larger population. Additionally, the investigator may choose to examine multiple outcomes simultaneously. Moreover, Future studies should integrate multi-disciplinary approaches to address this issue.
Conclusions
결론
MNP는 환경 어디에나 존재하며 인간은 여러 소스에서 MNP에 자주 노출됩니다.
MP와 NP에 노출되면 다양한 인간 기관 시스템에 부작용을 일으킬 수 있다는 증거가 늘어나고 있습니다.
여기에 요약된 이용 가능한 문헌은 MNP 노출이 산화 스트레스, 염증, 면역 기능 손상, 세포 및 에너지 대사의 변화, 세포 증식 억제, 조직 변성, 비정상적인 기관 발달 및 기능 장애, 생화학적 매개변수의 변화 및 심지어 유전독성을 유발할 수 있음을 나타냅니다.
그리고 발암성. 수많은 동물 및 세포 배양 연구에서 MNP가 인간 건강에 미치는 생물학적 부작용이 밝혀졌지만 근본적인 메커니즘은 아직 명확하지 않습니다.
또한, MNP에 대한 장기간 노출이 질병 감수성과 관련이 있는지 여부를 조사할 필요가 있습니다.
인간에서 MNP가 건강에 미치는 잠재적인 악영향과 관련 메커니즘을 조사하기 위해서는 추가 관찰 연구가 필요합니다.
또한 향후 연구에서 MNP가 인간 건강과 발병에 미치는 영향을 정량화하는 것이 중요합니다.
이는 현재 지식을 요약하고 연구 격차를 해소하는 데 도움이 될 것입니다.
MNPs are ubiquitous in the environment, and humans are frequently exposed to MNPs from multiple sources. The growing evidence suggests that exposure to MPs and NPs may cause adverse effects in different human organ systems. The available literature summarized here indicates that MNPs exposure may lead to oxidative stress, inflammation, impaired immune function, alteration in cellular and energy metabolism, inhibition in cell proliferation, tissue degeneration, abnormal organ development and dysfunction, alteration in biochemical parameters and even cause genotoxicity and carcinogenicity. Although numerous animal and cell culture studies indicated the adverse biological effects of MNPs on human health, the underlying mechanisms are still unclear. Furthermore, whether long-term exposure to MNPs is associated with disease susceptibility needs to be investigated. Further observational studies are necessary to investigate the potential adverse health consequences of MNPs in humans and the related mechanisms. Additionally, it is crucial to quantify the impact of MNPs on human health and their pathogenesis in future studies. This will help to summarize the current knowledge and address any research gaps.
Contributors
N.A., contributed to the conceptualization, data curation, writing and editing of the manuscript. J.K., E.L.M., and T.W.G. reviewed and edited some sections of the manuscript. S.W and J.B.d.l.S. contributed by critically reviewing and editing the manuscript. All authors read and approved the final version of the manuscript.